 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Обратимые и необратимые реакции. Константа равновесия
|
|
Обратимые и необратимые реакции.
Константа равновесия
В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия. При его наступлении она не может больше совершать полезную работу, поэтому термодинамическим критерием установления равновесия является следующее уравнение:
∆G = 0
Таким образом, любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Причем движущей силой данного процесса является изменение изобарно-изотермического потенциала системы ∆G. Чем ∆G меньше, тем дальше система находится от состояния равновесия и тем более она реакционноспособна. Равновесие может существовать только для обратимых реакций.
По признаку обратимости все химические реакции делятся на обратимые и необратимые.
Необратимые химические реакции при данных условиях самопроизвольно протекают только в одном направлении и при этом получившиеся продукты не взаимодействуют друг с другом с образованием исходных веществ. В связи с этим необратимые реакции заканчиваются либо полным расходованием всех исходных веществ (если они взяты в стехиометрическом соотношении), либо – одного из них, находящегося в недостатке (если исходные вещества взяты в нестехиометрическом соотношении). Реакция с высокой долей вероятности будет необратимой, если при ее протекании выделяется или затрачивается большое количество энергии. Исходя из этого, необратимыми являются реакции горения, многие реакции термического разложения сложных веществ, например:
С + О2 = СО2 + Q
СН4 + 2О2 = СО2 + 2Н2О + Q
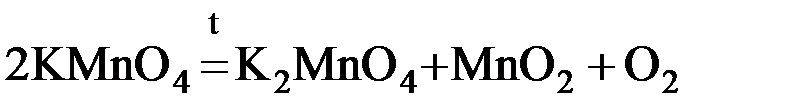
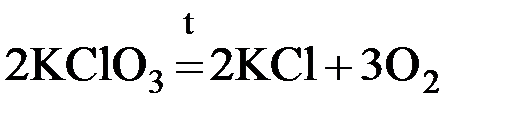
Необратимыми также могут быть реакции, при протекании которых один из продуктов удаляется из сферы реакции в виде осадка либо газа. Это особенно характерно для реакций обмена между электролитами, находящимися в растворенном состоянии, например:

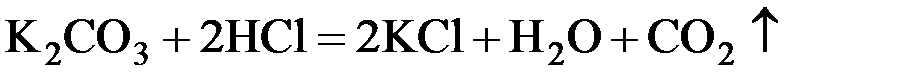
Большинство химических реакций являются обратимыми. Обратимые реакции протекают одновременно в двух противоположных направлениях и не заканчиваются полным расходованием всех, либо одного из исходных веществ, поэтому вместо знака равенства «=» в уравнениях таких реакций ставится знак обратимости «» («↔»).
В начальный момент времени (когда в системе присутствуют только исходные вещества) протекает лишь прямая реакция, идущая слева направо. Скорость ее при этом будет максимальной, но в дальнейшем (по мере расходования исходных веществ и уменьшения их концентрации) скорость прямой реакции будет падать (рис. 13).
В результате протекания прямой реакции в системе появятся и начнут накапливаться конечные вещества, которые будут взаимодействовать между собой. Это приведет к возникновению обратной реакции, идущей справа налево. Скорость ее в начальный момент времени будет равна нулю, но затем (в связи с увеличением концентрации конечных веществ) начнет плавно возрастать (рис. 13).
С течением времени, любая обратимая реакция заканчивается установлением химического равновесия, т.е. такого состояния системы, при котором скорости прямой и обратной реакции становятся равными (рис. 13). Такое равновесие называется динамическим или подвижным, т.к. обе реакции не прекра-
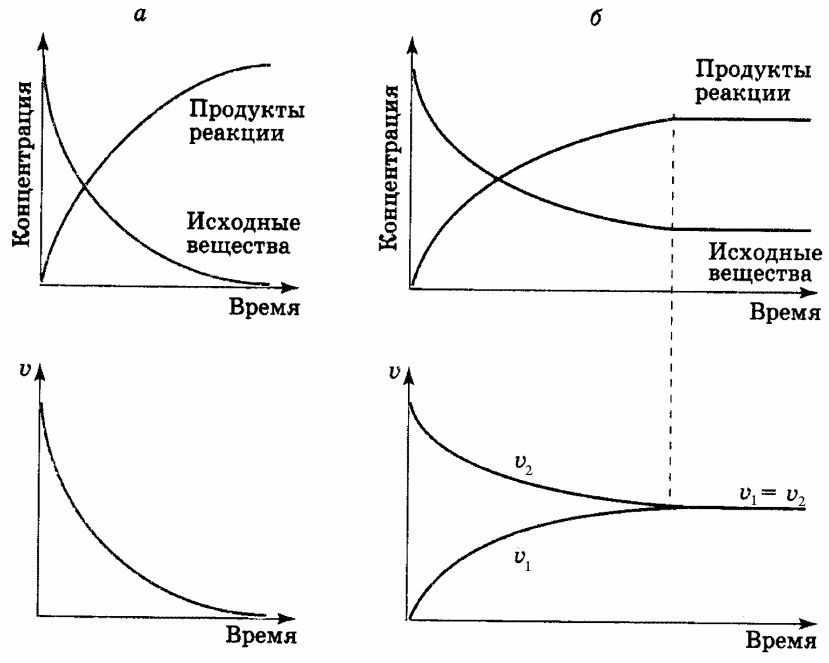
Рис. 13. Изменение концентраций веществ и скоростей необратимой (а) и обратимой (б) реакций.
щаются, но при этом концентрации исходных и конечных веществ остаются неизменными. Они называются иначе равновесными концентрациями.
Это объясняется тем, что в состоянии равновесия число молекул исходных веществ, прореагировавших в единицу времени, равно числу молекул этих же веществ, образовавшихся за то же время из продуктов реакции. До наступления равновесия концентрации исходных веществ непрерывно уменьшаются по сравнению с начальными, а концентрации продуктов реакции, наоборот, возрастают.
Как следует из рисунка 14, состояния химического равновесия в случае обратимой реакции можно достичь двумя путями: из начального состояния системы, в котором находятся только исходные вещества (точка x на графике), либо из начального состояния системы, в котором находятся только продукты реакции (точка y на графике).
Опытным путем было установлено, что для большинства обратимых реакций в условиях их протекания величина |∆G| как прямой, так и обратной реакции обычно не превышает
10 кДж /моль.
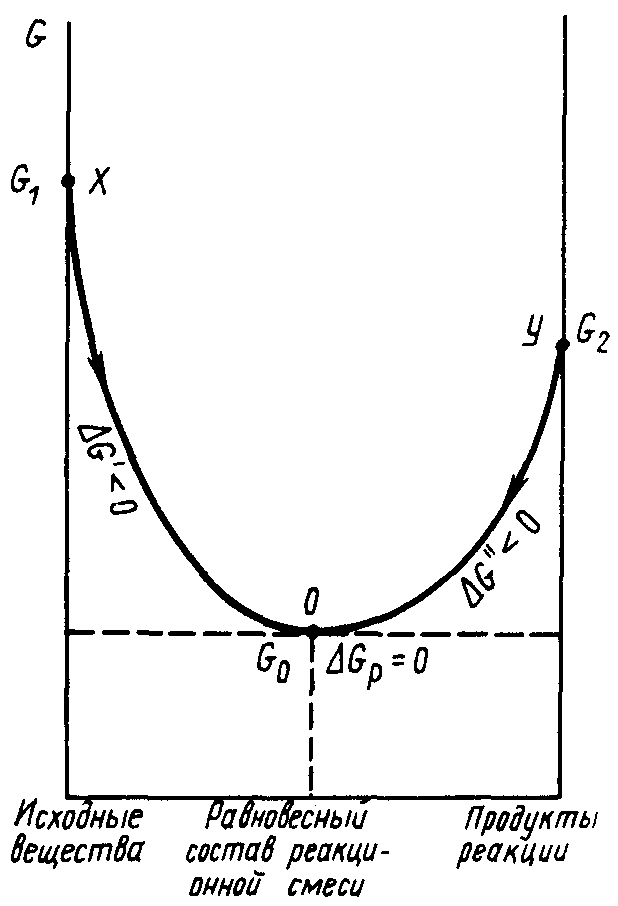
Рис. 14. Изменение энергии Гиббса химической системы при протекании в ней обратимой химической реакции
Если же для одной из реакций |∆G| >> 10 кДж /моль, то она становится необратимой по направлению. Следует иметь в виду, что реакции, необратимые в одних условиях, могут стать обратимыми при их изменении.
Многие реакции являются обратимыми в условиях, отличных от стандартных. В этом случае для расчета ∆G химической реакции в состоянии равновесия необходимо использовать ∆G образования исходных и конечных веществ именно для этих, а не стандартных условий.
Установлено, что если реакция осуществляется в газовой фазе, то ∆G образования 1 моля газа при парциальном давлении p (отличном от стандартного значения) равна
∆Gобр = ∆  + RT ln p
+ RT ln p
Для реакций, протекающих в растворе, ∆G образования вещества рассчитывается аналогично:
∆Gобр = ∆  + RT ln C
+ RT ln C
где C – равновесная молярная концентрация растворенного вещества, отличная от стандартного значения, т.е. от 1 моль/л.
Рассмотрим обратимую химическую реакцию, протекающую в газовой фазе
aA + bB ↔ cC + dD
Как известно ∆G химической реакции равно сумме ∆G образования продуктов реакции за вычетом суммы ∆G образования исходных веществ (с учетом их стехиометрических коэффициентов)
∆Gх.р. = с ∆Gобр.С + d ∆Gобр.D – a ∆Gобр.A – b ∆Gобр.B =
= с ∆ 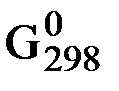 С + с RT ln pС + d ∆
С + с RT ln pС + d ∆  D + d RT ln pD – a ∆
D + d RT ln pD – a ∆ 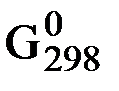 A –
A –
– a RT ln pA – b ∆ 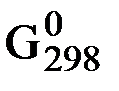 B – b RT ln pB;
B – b RT ln pB;
Данное уравнение можно преобразовать
∆Gх.р. = с ∆ 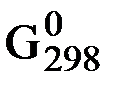 С + d ∆
С + d ∆ 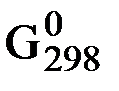 D – a ∆
D – a ∆ 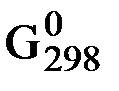 A – b ∆
A – b ∆  B +
B +
∆ 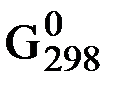 х.р.
х.р.
+ с RT ln pС + d RT ln pD – a RT ln pA – b RT ln pB;
В окончательном варианте его можно записать таким образом
∆Gх.р. = ∆ 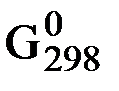 х.р. + RT ln
х.р. + RT ln 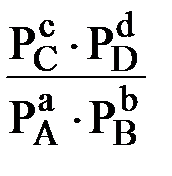
Так как при равновесии ∆Gх.р. = 0, то
∆ 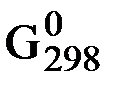 х.р. = - RT ln
х.р. = - RT ln 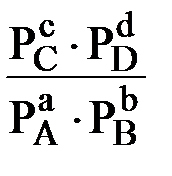
где PA, PB, PC, и PD являются равновесными парциальными давлениями веществ A, B, C и D.
Как следует из последнего уравнения, выражение под знаком логарифма есть величина постоянная при данной температуре T. Она называется иначе константой химического равновесия Kравн.
Таким образом, для изобарно-изотермических условий
∆G°298 х.р. = - RT ln Kравн.
Рассуждая подобным образом, для этой же реакции
aA + bB ↔ cC + dD,
но уже протекающей в растворе, можем вывести аналогичные уравнения:
1) ∆G х.р. = ∆ 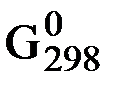 х.р. + RT ln
х.р. + RT ln 
Дата публикования: 2014-11-03; Прочитано: 1164 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
