 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние температуры и давления на тепловой эффект реакции
|
|
Используя справочные данные теплот образования или теплот сгорания химических веществ, можно теоретически рассчитать тепловой эффект реакции, протекающей при стандартных условиях.
Но как быть в тех случаях, когда необходимо знать тепловой эффект процесса при иных температурах и давлении (отличных от стандартных условий)?
В первом приближении можно принять, что изменения температуры и давления мало отражаются на величине DН (химической реакции). Так, например, для реакции
N2 (г) + 3H2 (г) = 2NH3 (г)
различие между DН р = 100 кПа и DН р = 50 000 кПа составляет всего около 5%, а для реакции
С (графит) + СО2 (г) = 2СО (г)
DНо298 = 172,38 кДж, а DНо1500 = 165,27 кДж (различие составляет» 4%).
Однако такая закономерность наблюдается не всегда. В ряде процессов изменение DН (химической реакции) с температурой может быть значительным даже в узком интервале температур. В общем случае оно будет тем больше, чем больше сумма теплоемкостей продуктов реакции отличается от суммы теплоемкостей исходных веществ. В таких случаях тепловой эффект реакции определяют по закону Кирхгофа:
DН (химической реакции) = DНо298 + 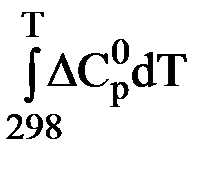
где DCор – разность молярных теплоемкостей продуктов реакции и исходных веществ (с учетом стехиометрических коэффициентов).
Молярной теплоемкостью вещества называется количество теплоты, которое необходимо сообщить одному молю вещества, чтобы изменить его температуру на один градус Кельвина.
По приведенному уравнению можно рассчитывать тепловой эффект реакции только для интервала температур, при котором в системе не происходит межфазовых превращений и изменений в кристаллической решетке твердого вещества.
Дата публикования: 2014-11-03; Прочитано: 914 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
