 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Данное выражение называется иначе уравнением изотермы химической реакции
|
|
2) ∆ 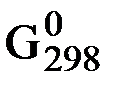 х.р. = - RT ln
х.р. = - RT ln 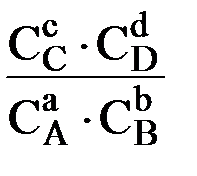
(С учетом того, что в условиях химического равновесия ∆G х.р. = 0).
В этом случае Kравн. = 
где СA, СB, СC, и СD – равновесные молярные концентрации исходных и конечных веществ.
Таким образом, Kравн. обратимой реакции, протекающей в растворе при постоянных температуре и давлении равна произведению равновесных молярных концентраций конечных веществ, деленному на произведение равновесных молярных концентраций исходных веществ (с учетом их стехиометрических коэффициентов).
Константа равновесия для данной обратимой реакции есть величина постоянная и при одних и тех же условиях не зависит от равновесных концентраций конечных и исходных веществ, а меняется только от температуры.
Введение в систему катализатора не влияет на величину константы равновесия. Это объясняется тем, что катализатор в равной мере уменьшает энергию активации как прямой, так и обратной реакций, и поэтому на отношение констант их скоростей он не оказывает влияния. Катализатор только изменяет время наступления химического равновесия, т.е. уменьшает при положительном катализе и увеличивает при отрицательном катализе (рис. 15).
Численное значение константы равновесия приблизительно характеризует выход продуктов данной реакции. Например, при К >>1 выход продуктов значителен, т.к. при этом произведение равновесных молярных концентраций конечных веществ много больше произведения аналогичных концентраций исходных веществ, а значит, и сами равновесные молярные концентрации продуктов больше равновесных концентраций исходных веществ.
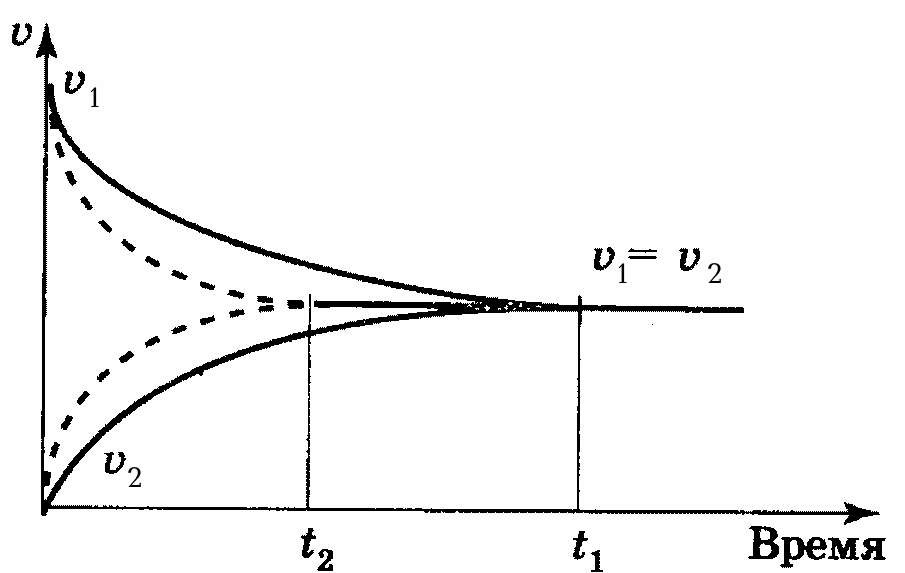
Рис. 15. Влияние катализатора на время установления равновесия в обратимой реакции без катализатора (t1) и в присутствии катализатора (t2).
При К << 1 (по аналогичной причине) выход продуктов реакции мал.
Смещение химического равновесия.
Принцип Ле-Шателье
Состояние равновесия для обратимой реакции может длиться неограниченно долгое время (без вмешательства извне). Но если на такую систему оказать внешнее воздействие (изменить температуру, давление или концентрацию конечных либо исходных веществ), то состояние равновесия нарушится. Скорость одной из реакций станет больше по сравнению со скоростью другой. С течением времени система вновь займет равновесное состояние, но новые равновесные концентрации исходных и конечных веществ будут отличаться от первоначальных. В этом случае говорят о смещении химического равновесия в ту или иную сторону.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то это значит, что химическое равновесие сместилось вправо. Если же, наоборот, становится больше скорость обратной реакции, это значит, что химическое равновесие сместилось влево.
При смещении равновесия вправо происходит уменьшение равновесных концентраций исходных веществ и увеличение равновесных концентраций конечных веществ по сравнению с первоначальными равновесными концентрациями. Соответственно, при этом возрастает и выход продуктов реакции.
Смещение химического равновесия влево вызывает возрастание равновесных концентраций исходных веществ и уменьшение равновесных концентраций конечных продуктов, выход которых при этом уменьшится.
Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
Например, при увеличении концентрации исходных веществ возрастает скорость прямой реакции и равновесие смещается вправо. При уменьшении концентрации исходных веществ, наоборот, возрастает скорость обратной реакции, а химическое равновесие смещается влево.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Следует подчеркнуть, что увеличение температуры, как правило, увеличивает скорость и прямой, и обратной реакции, но при этом скорость эндотермической реакции возрастает в большей степени, чем скорость экзотермической реакции. Соответственно, при охлаждении системы скорости прямой и обратной реакций уменьшаются, но тоже не в одинаковой степени: для экзотермической реакции существенно меньше, чем для эндотермической.
Изменение давления влияет на смещение химического равновесия только при выполнении двух условий:
1) необходимо, чтобы хоть одно из веществ, участвующих в реакции, находилось в газообразном состоянии, например:
t
СаСО3(т) СаО(т)+ СО2(г) - изменение давления влияет на смещение равновесия.
СН3СООН(ж.) + С2Н5ОН(ж.) СН3СООС2Н5(ж.) + Н2О(ж.) – изменение давления не влияет на смещение химического равновесия, т.к. ни одно из исходных или конечных веществ не находится в газообразном состоянии;
2) если в газообразном состоянии находятся несколько веществ, необходимо, чтобы число молекул газа в левой части уравнения такой реакции не было равно числу молекул газа в правой части уравнения, например:
t, каt
2SO2(г)+O2(г) 2SO3(г) – изменение давления влияет на смещение равновесия
I2(г)+ Н2(г) 2НI(г) – изменение давления не влияет на смещение равновесия
При выполнении этих двух условий увеличение давления приводит к смещению равновесия в сторону реакции, протекание которой уменьшает число молекул газа в системе. В нашем примере (каталитическое горение SO2) это будет прямая реакция.
Уменьшение давления, наоборот, смещает равновесие в сторону реакции, идущей с образованием большего числа молекул газа. В нашем примере это будет обратная реакция.
Увеличение давления вызывает уменьшение объема системы, а значит, и увеличение молярных концентраций газообразных веществ. В результате скорость прямой и обратной реакций увеличивается, но не в одинаковой степени. Понижение же давления по аналогичной схеме приводит к уменьшению скоростей прямой и обратной реакций. Но при этом скорость реакции, в сторону которой смещается равновесие, уменьшается в меньшей степени.
Катализатор не влияет на смещение равновесия, т.к. он в одинаковой степени ускоряет (или замедляет) как прямую, так и обратную реакцию. В его присутствии химическое равновесие только быстрее (или медленнее) устанавливается.
Если на систему оказывают воздействие сразу несколько факторов одновременно, то каждый из них действует независимо от других. Например, при синтезе аммиака
t,kat
N2(газ)+ 3H2(газ) 2NH3(газ)
реакцию осуществляют при нагревании и в присутствии катализатора для увеличения ее скорости. Но при этом воздействие температуры приводит к тому, что равновесие реакции смещается влево, в сторону обратной эндотермической реакции. Это вызывает уменьшение выхода NH3. Чтобы компенсировать данное нежелательное действие температуры и увеличить выход аммиака, одновременно в системе повышают давление, которое смещает равновесие реакции вправо, т.е. в сторону образования меньшего числа молекул газа.
При этом опытным путем подбирают наиболее оптимальные условия осуществления реакции (температуру, давление), при которых она протекала бы с достаточно большой скоростью и давала экономически рентабельный выход конечного продукта.
Принцип Ле-Шателье аналогичным образом используется в химической промышленности при производстве большого числа различных веществ, имеющих огромное значение для народного хозяйства.
Принцип Ле-Шателье применим не только к обратимым химическим реакциям, но и к различным другим равновесным процессам: физическим, физико-химическим, биологическим.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе различных биохимических показателей, включающих в себя концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесным, т.к. оно не приложимо к открытым системам.
Организм человека, как любая живая система, постоянно обменивается с окружающей средой различными веществами: потребляет продукты питания и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство его параметров при постоянной скорости обмена с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд равновесных состояний, связанных между собой процессами релаксации. В состоянии равновесия концентрации веществ, участвующих в реакции, поддерживаются за счёт восполнения извне исходных и удаления наружу конечных продуктов. Изменение их содержания в организме не приводит, в отличие от закрытых систем, к новому термодинамическому равновесию. Система возвращается в первоначальное состояние. Таким образом, поддерживается относительное динамическое постоянство состава и свойств внутренней среды организма, обусловливающее устойчивость его физиологических функций. Данное свойство живой системы называется иначе гомеостазом.
В ходе жизнедеятельности организма, находящегося в стационарном состоянии, в отличие от закрытой равновесной системы, происходит увеличение энтропии. Однако, наряду с этим, одновременно протекает и обратный процесс – уменьшение энтропии за счёт потребления из окружающей среды питательных веществ с низким значением энтропии (например, высокомолекулярных соединений – белков, полисахаридов, углеводов и др.) и выделения в среду продуктов распада. Согласно положению И.Р.Пригожина, суммарное производство энтропии для организма, находящегося в стационарном состоянии, стремится к минимуму.

Большой вклад в развитие неравновесной термодинамики внес И. Р. Пригожий, лауреат Нобелевской премии 1977 г., который утверждал, что «в любой неравновесной системе существуют локальные участки, находящиеся в равновесном состоянии. В классической термодинамике равновесие относится ко всей системе, а в неравновесной — только к ее отдельным частям».
Установлено, что энтропия в таких системах возрастает в период эмбриогенеза, при процессах регенерации и росте злокачественных новообразований.
Дата публикования: 2014-11-03; Прочитано: 905 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
