 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ингибирование ферментов
|
|
Ингибиторы - вещества, тормозящие действие ферментов. Различают обратимое и необратимое ингибирование (инактивация). Примерами необратимого ингибирования является действие солей тяжелых металлов, йодацетата, синильной кислоты и др.
В случае необратимого ингибирования молекула ингибитора вызывает стойкие, необратимые изменения или модификацию активного центра фермента. Чаще имеет место обратимое ингибирование, которое, в свою очередь, делят на конкурентное и неконкурентное.
При конкурентном ингибировании ингибитор, обладая структурным сходством с субстратом, соединяется с ферментом, подменяя собой субстрат, конкурируя с ним. Так как часть фермента расходуется на образование комплекса фермент-ингибитор, то количество фермент-субстратного комплекса снижается, и падает скорость ферментативной реакции. Конкурентные ингибиторы, таким образом, подавляют активность только одного фермента или группы ферментов со сходным активным центром. Механизм конкурентного ингибирования можно выразить следующей схемой:
F + S = FS = F + P;
F + I = FI,
где F - фермент; S - субстрат; I - ингибитор, Р - продукт.
Если повышать концентрацию субстрата, то доля комплекса FS увеличивается, а комплекса FI уменьшается. При достаточно высокой концентрации субстрата весь фермент будет в форме комплекса FS, и скорость реакции будет максимальной, несмотря на присутствие ингибитора.
В качестве примера конкурентного ингибирования рассмотрим торможение действия фермента холинэстеразы при помощи диизопропилфторфосфата, который является ингибитором также и других эстераз и пептидгидролаз, имеющих серии в активном центре.
Холинэстераза - фермент, каталитически ускоряющий гидролиз ацетилхолина на холин и уксусную кислоту:

| Ацетилхолин | Уксусная кислота | Холин |
Реакция идет с большой скоростью: одна молекула холинэстеразы разлагает за одну минуту несколько миллионов молекул ацетилхолина. Этот процесс имеет огромное значение для нервной системы, так как ацетилхолин является промежуточным соединением в передаче нервного импульса. Действие холинэстеразы угнетается сильнейшим нервным ядом - диизопропилфторфосфатом, структура которого в некоторой части молекулы подобна структуре ацетилхолина:
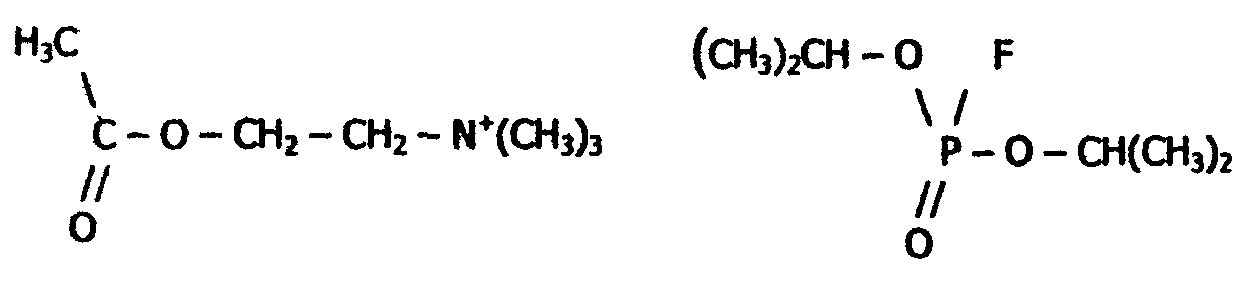
| Ацетилхолин | диизопропилфторфосфат |
К активному центру холинэстеразы вместо группировки 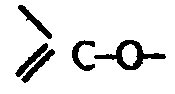
- ацетилхолина легко присоединяется группировка 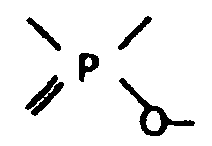 диизопропилфторфосфата: наступает торможение работы фермента со всеми вытекающими отсюда для организма последствиями.
диизопропилфторфосфата: наступает торможение работы фермента со всеми вытекающими отсюда для организма последствиями.
Примером конкурентного ингибирования служит также торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую:

Малонат в результате структурного сходства с субстратом (сукцинат) реагирует с активным центром СДГ с образованием фермент–ингибитор -комплекса, однако при этом перенос водорода от малоната не происходит.
Метод конкурентного торможения нашел широкое применение в медицинской практике. Например, для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Эти препараты имеют сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству, сульфаниламид блокирует действие фермента путем вытеснения параминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий:
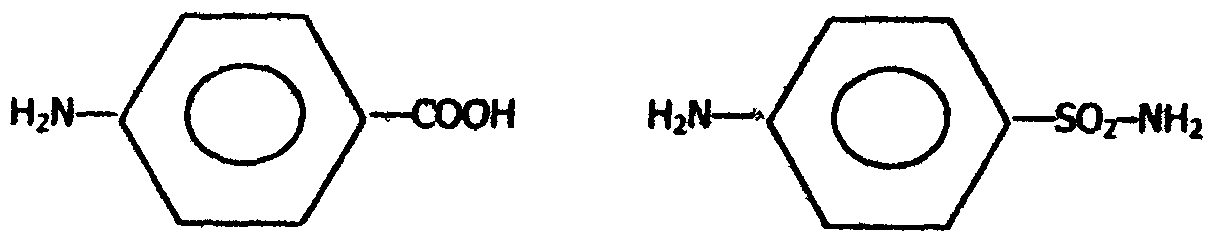
| n-аминобензойная кислота | сульфаниламид |
Некоторые аналоги витамина В6 и фолиевой кислоты, например, дезоксипиридоксин и аминоптерин, действуют как конкурентные коферментные ингибиторы (или антивитамины), тормозящие многие биохимические процессы в организме.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами. При этом ингибитор влияет на каталитическое превращение, но не на связывание субстрата с ферментом. Неконкурентный ингибитор или связывается непосредственно с каталитическим участком активного центра, или, связываясь с ферментом в одном из аллостерических центров, изменяет конформацию активного центра таким образом, что затрагивает структуру каталитического участка. Так как неконкурентный ингибитор не влияет на связывание субстрата, то в отличие от конкурентного ингибирования наблюдается образование тройного комплекса по уравнению
F + S +I→ FSI.
Однако превращения этого комплекса в продукты реакции не происходит.
Примером неконкурентного ингибирования может служить блокирование ферментов ионами тяжелых металлов (Hg, As, Pb, Cd), которые присоединяются к сульфогидрильным (-SH) группам полипептидной цепи каталитического участка. Торможение солями синильной кислоты, угарным газом основано на том, что анионы СN¯ или молекулы СО прочно соединяются с трехвалентным железом, входящим в каталитический участок геминового фермента - цитохромоксидазы. Блокада этого фермента выключает дыхательную цепь, и клетка погибает.
Снять действие неконкурентного ингибитора избытком субстрата (как действие конкурентного) нельзя, а можно лишь веществами, связывающими ингибитор. Эти вещества называют реактиваторами.
Ионы тяжелых металлов лишь в небольших концентрациях являются неконкурентными ингибиторами. В больших концентрациях они выступают как инактиваторы (оказывают денатурирующее действие).
Неконкурентные ингибиторы применяются как фармакологические средства, отравляющие вещества для борьбы с вредителями сельского хозяйства и в военных целях.
Дата публикования: 2015-11-01; Прочитано: 2629 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
