 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Определение активности ферментов
|
|
В основе всех методов определения активности ферментов лежит положение, согласно которому активность ферментов определяется количеством превращенного субстрата при определенных стандартных условиях: концентрации субстрата, температуре и рН среды. При определении активности фермента следует не забывать о том, что она резко меняется при различных условиях реакции. Различные методы количественного определения активности ферментов основаны на следующих принципах:
1) определяется наименьшее количество ферментного препарата, способного за определенный промежуток времени и при определенных условиях расщепить требуемое количество субстрата;
2) определяется остаток субстрата после воздействия фермента и затем рассчитывается количество субстрата, расщепившегося под действием определенного количества фермента;
3) активность фермента обозначают по времени, в течение которого определенная навеска фермента катализирует превращение определенной доли субстрата в стандартных условиях (начальная концентрация субстрата, температура, рН среды).
Согласно правилам, рекомендованным в 1961 году Комиссией по ферментам Международного биохимического союза, за единицу фермента (Е) принимают такое его количество, которое катализирует превращение 1 мкмоль вещества (субстрата) за 1 минуту. Число единиц фермента в тканях определяют по формуле:
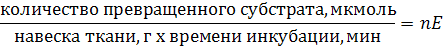
Часто находят удельную активность фермента: она равна числу единиц фермента в образце, деленному на массу белка (в мг) в этом образце. Например, если в 1 грамме ткани печени содержится 140 единиц лактатдегидрогеназы и 200 мг белка, то удельная активность лактатдегидрогеназы в печени равна 140/200=0,7 (мкмоль/мин)/мг. Если имеется очищенный индивидуальный фермент, то можно измерить его молярную активность: она равна числу единиц фермента в образце, деленному на количество фермента в микромолях. Молярная активность указывает, сколько молекул субстрата превращается одной молекулой фермента за 1 минуту.
Для правильного определения активности фермента необходимо проводить его в стандартных условиях, которые устанавливаются для каждого фермента из предварительных кинетических исследований, и точно измерять изменение содержания субстрата или продукта реакции за определенный, отрезок времени.
Рекомендуется проводить определение активности фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения.
Дата публикования: 2015-11-01; Прочитано: 1813 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
