 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Номенклатура и классификация ферментов
|
|
До 1961 года не существовало единого подхода к образованию названий ферментов. Исторически возникшие (тривиальные) названия ферментов строились либо по названию субстрата с изменением суффикса на -аза (например, уреаза, гистидаза, аргиназа), либо по характеру действия, например, пепсин (от греческого «легкие» - пищеварение) или трипсин (от греческого «трипсис» - разжижаю) и так далее. В 1961 году на V Международном биохимическом конгрессе в Москве были разработаны и утверждены правила рациональной номенклатуры ферментов.
Согласно этим правилам название фермента составляют из химического названия субстрата и названия той реакции, которая осуществляется ферментом. Если данная реакция сопровождается переносом группы атомов от одного партнера (субстрата) к другому (акцептору), то в название фермента включают еще и химическое наименование акцептора. Например, пиридоксальфермент, катализирующий реакцию переаминирования между L-аланином и 2-оксоглутаровой кислотой, должен называться L-аланин: оксоглутарат-аминотрансфераза:
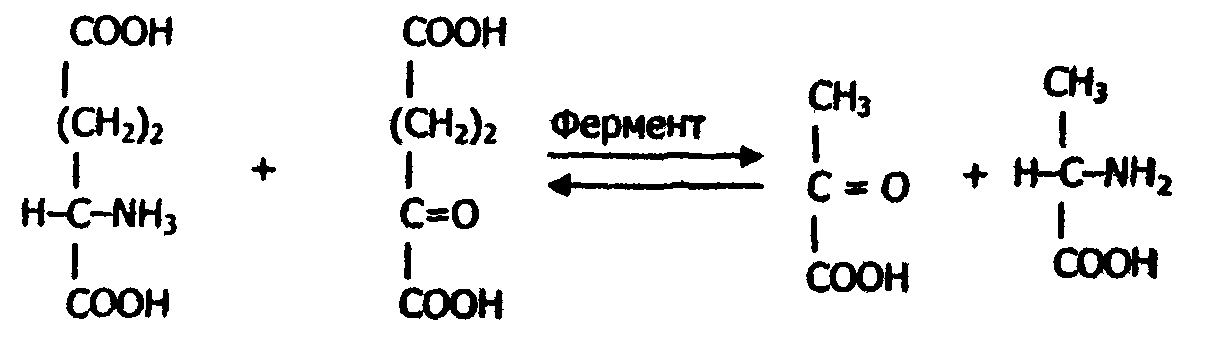
| L-аланин (субстрат, донор) | 2-оксоглутаровая кислота (акцептор) | Пировиноградная кислота | Глутаминовая кислота |
Названия ферментов по рациональной номенклатуре являются точными и содержательными, но очень длинными. Поэтому наряду с рациональными названиями до сих пор используются тривиальные названия ферментов.
Классификация ферментов основана на типе катализируемой ферментом реакции. Все ферменты делятся на шесть главных классов, каждый из которых имеет строго определенный номер. Классы разделены на подклассы и далее на подподклассы.
Название класса указывает тип химической реакции, катализируемой ферментом. Подкласс уточняет действие фермента, указывая в общих чертах на природу химической группы субстрата, атакуемой ферментом. Подподкласс ещё более конкретизирует действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
1. Оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции. Среди оксидоредуктаз различаются дегидрогеназы, катализирующие перенос водорода (протонов и электронов), и оксидазы, катализирующие окисление субстрата кислородом. К этому же классу относятся гемсодержащие ферменты каталаза и пероксидаза. Оксидоредуктазы очень распространенный класс, насчитывающий около 480 ферментов. Большую роль они играют в энергетических процессах. Название ферментов этого класса составляют по схеме: «донор: акцептор – оксидоредуктаза».
2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов от одного субстрата (донора) к другому (акцептору). Сюда относятся аминотрансферазы, ацилтрансферазы, метилтрансферазы, фосфотрансферазы и другие. Трансферазы - примерно столь же обширный класс, как и оксидоредуктазы. Они участвуют в реакциях взаимопревращения различных веществ, синтезе мономеров, обезвреживании природных и чужеродных соединений. Названия ферментов этого класса строят следующим образом: "донор: транспортируемая группа - трансферазы''.
3. Гидролазы - катализируют реакции расщепления внутримолекулярных связей с присоединением воды по месту расщепления:
А — В + Н-ОН →А—ОН + Н—В.
К гидролазам относятся эстеразы - катализирующие реакции гидролиза и синтеза сложноэфирных связей (липаза, холинэстераза); пептидазы, или пептидгидролазы (пепсин, трипсин, карбоксипептидаза), расщепляющие пептидные связи; гликозидазы, гидролизующие гликозидные связи, и так далее. Класс гидролаз насчитывает около 460 ферментов.
Гидролазами являются пищеварительные ферменты, ферменты лизосом и других органоидов клетки, где они способствуют распаду биополимеров на мономеры. Тривиальное название этих ферментов образуется добавлением к названию субстрата окончания - аза. Систематическое название получают по схеме: "субстрат - гидролаза".
4. Лиазы - катализируют разрыв связей С-О, С-С, C-N и обратимые реакции отщепления различных групп от субстратов негидролитическим путем, в результате чего происходит образование двойной связи или присоединяются группы по месту двойной связи. Примеры лиаз - декарбоксилазы (отщепляют СООН - группу от карбоновых кислот); альдолазы (расщепляют связь С-С с образованием альдегида); гидратазы (присоединяют воду по двойной связи); дегидратазы (отщепляют молекулу воды с образованием двойной связи); амидин-лиазы (отщепляют аминогруппу) и другие.
Лиазы - менее распространенная группа ферментов (около 230), участвующие в реакциях синтеза и распада промежуточных продуктов обмена. Систематическое название составляется по схеме: "субстрат-лиаза". В тривиальных названиях указываются особенности участвующих в реакции групп атомов - карбоксилаза (присоединение карбоксильной группы), дегидратаза (отщепление молекулы воды).
5. Изомеразы - катализируют различные реакции изомеризации, которые можно разделить на две группы. Первая - реакции внутримолекулярного переноса групп; вторая - внутримолекулярные окислительно-восстановительные реакции. Первый тип реакций катализируют изомеразы, которые называют мутазами и которые являются внутримолекулярными трансферазами. Сюда относят внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы. Например, фосфоглицеромутаза превращает 3-фосфоглицериновую кислоту в 2-фосфоглицериновую кислоту:
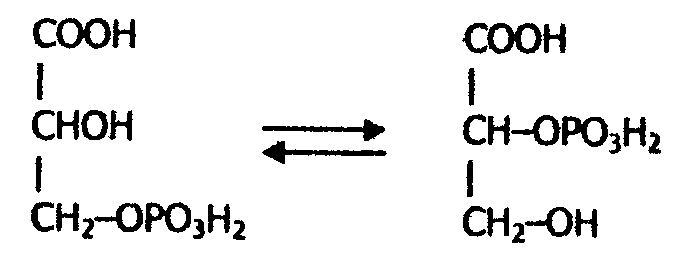
К первому типу относят также рацемазы и эпимеразы, действующие на амино- и оксикислоты; таутомеразы.
Второй тип реакции изомеризации катализируют внутримолекулярный перенос кислорода или водорода, обеспечивающие взаимопревращение альдоз и кетоз. Например, триозофосфатизомераза катализирует взаимопревращение диоксиацетонфосфата и глицеральдегидфосфата.
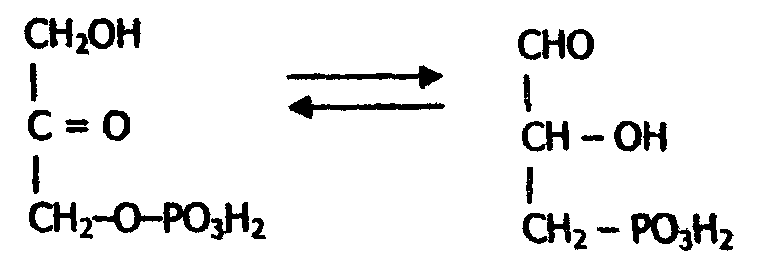
Изомеразы - небольшая группа ферментов (чуть более 80), играющая важную роль в восстановлении биологической активности молекул. Название этих ферментов складывается в зависимости от типа реакции по схеме: "субстрат - изомераза".
6. Лигазы (синтетазы) - катализируют синтез органических веществ из двух исходных молекул с участием какого-либо нуклеозид-трифосфата, при распаде которого освобождается необходимая для синтеза энергия. Ферментов этого класса насчитывается около 80. Систематическое название лигаз образуется по схеме: «Х:У-лигаза», где X и Y -исходные вещества. Например, L-глутамат: аммиак - лигаза (или тривиальное название глутаминсинтетаза).
Дата публикования: 2015-11-01; Прочитано: 2032 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
