 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Органический синтез на основе предельных углеводородов
|
|
Сырьем для синтеза многих органических продуктов служат предельные углеводороды. Широкое применение из методов переработки предельных углеводородов находит окисление, хлорирование, сульфирование, сульфохлорирование и др.
В зависимости от условий процесса при окислении углеводородов получают спирты, альдегиды, кислоты, СО, Н2 и др. Окислением низших парафинов в газовой фазе получают формальдегид, метиловый спирт, ацетальдегид:

При окислении парафиновых углеводородов С15—-С30 кислородом воздуха получают жирные кислоты, высшие спирты, моющие и поверхностно-активные вещества:

Окислением нафтеновых углеводородов, например циклогексана, получают циклогексанол C6H12О, циклогексанон С6Н10О, адипиновую кислоту НООС—(СН2)4—СООН. Хлорированием предельных углеводородов получают различные хлорзамещенные продукты, используемые далее для производства высокомолекулярных соединений (хлористый винил, хлоропрен, тетрафторэтилен и др.), полупродуктов органического синтеза (хлористые метил, этил, аллил и бензил, хлорбензол и др.), а также применяемые в качестве растворителей (хлористый метилен, ССЦ и др.), хладоагентов (хлороформ, хлористый этил и др.), для борьбы с вредителями сельского хозяйства, в качестве смазочных масел и т. д.
Хлорированию подвергают жидкие (парафиновые, нафтеновые и ароматические) и газообразные (метан, этан, пропан и др.) углеводороды. Для получения хлорированных углеводородов применяют термическое, фотохимическое, каталитическое хлорирование и хлорирование, инициируемое радикалами.
Термическое хлорирование проводят при нагревании смеси углеводородов и хлора до температуры диссоциации хлора на атомы (250°С). Чем устойчивее углеводород, тем должна быть выше температура хлорирования, так, например, для хлорирования бутана требуется нагревание до 250 °С, а метана — до 400 °С.
При фотохимическом хлорировании молекулы хлора диссоциируют под влияием фотонов или кванта энергии, например:

Каталитическое хлорирование ведут в присутствии хлоридов металлов переменной валентности (Cu2Cl2, FeCl3, SbCl5).
При жидкофазном хлорировании атомы хлора образуются при действии на молекулу С12 продуктов разложения перекиси или азосоединений, вводимых в жидкие углеводороды, например:
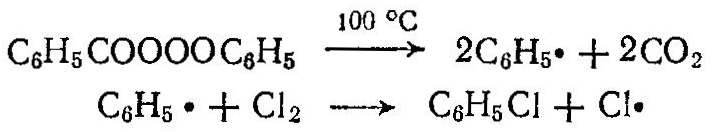
При хлорировании метана образуются хлорсодержащие углеводороды; при этом протекают следующие реакции:
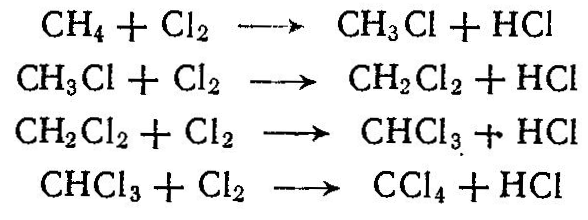
Процесс осуществляют при 400—480 °С в цилиндрических реакторах, футерованных диабазовыми плитками. При хлорировании образуется смесь, содержащая хлористый метил СН3С1, хлористый метилен СН2С12 хлороформ СНС13 и четыреххлористый углерод СС14. Выход этих продуктов [в %(мол.)] зависит от мольного соотношения С12: СН4.
Выход товарных продуктов составляет 85—99% от израсходованного метана. При тщательном разделении можно получить продукты 99—99,5%-ной чистоты.
Хлорирование этана и пропана проводят при 300—400°С и в избытке углеводорода. При хлорировании этана в основном образуются хлористый этил и небольшое количество дихлорэтана:

При хлорировании пропана образуются монохлориды (2-хлорпропан и 1-хлорпропан) и полихлориды.
Дата публикования: 2015-10-09; Прочитано: 2055 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
