 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Функції простих ліпідів
|
|
| Клас сполук | Складові компоненти | Функції |
| Воски | Залишки одноатомних спиртів і жирних кислот | Утворюють водонепроникні шари на поверхні тіла. Входять до складу зовнішнього скелета комах. Використовуються бджолами для будівництва стільників |
| Тригліцериди (жири) | Залишки триатомного спирту гліцерину і жирних кислот | Виконують структурні й енергетичні функції. Є основою біологічних мембран. Тригліцериди, які за температури 20°С залишаються твердими, традиційно називають жирами, а ті, які за цієї температури є рідкими, – оліями |
| Стероїди та терпени | Поліциклічні гідрофобні спирти | Виконують структурні, регуляторні й захисні функції. Відіграють важливу роль в обміні речовин |
Найчастіше прості ліпіди це складні ефіри триатомного спирту гліцерину і жирних кислот. Цю групу сполук називають тригліцеридами. Група восків утворюється внаслідок взаємодії жирних кислот з одноатомними спиртами. Крім того, до групи простих ліпідів включають стероїди й терпени, які є похідними ізопренів і не містять у своєму складі жирних кислот.
Функції ліпідів:
Структурна – ліпіди є основою клітинних мембран та основною складовою жирової тканини.
Енергетична – ліпіди є одним з основних джерел енергії у тварин і ряду рослин, крім того, як вітаміни вони беруть участь у цілому ряді реакцій обміну речовин.
Запасаюча – ліпіди дозволяють організмам ефективно запасати енергію, крім того, вони можуть бути джерелом ендогенної води, яка утворюється внаслідок їх окиснення.
Захисна – ліпіди у складі мембран захищають вміст клітин від потрапляння шкідливих речовин і втрати корисних, а жирова тканина захищає організм від утрати тепла й пошкоджень внутрішніх органів під час ударів; деякі ліпіди є захисними речовинами, що захищають організм від проникнення паразитів і збудників захворювань.
Регуляторна – ліпіди утворюють важливі гормони, які регулюють життєдіяльність організмів.
?2.6 Амінокислоти – це органічні кислоти, що містять аміногрупу (
-NH2), яким притаманні лужні властивості та карбоксильну групу (-СООН) з кислотними властивостями. Ці групи, як і атом гідрогену, зв’язані з одним і тим самим атомом карбону. Є у складі амінокислот й специфічні для кожної з них частини. Їх називають радикалами (R-групами). Загальна формула амінокислоти має вигляд:
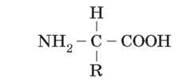
Для утворення білків живі організми використовують двадцять амінокислот, тобто існує двадцять варіантів амінокислотного радикала.
Під час взаємодії між карбоксильною групою однієї амінокислоти й аміногрупою іншої утворюється так званий пептидний зв’язок (від грец. пептос – зварений), а завдяки такому міцному зв’язку утворюється сполука, яка складається із залишків двох амінокислот – дипептид. Структури, які складаються з великої кількості залишків амінокислот (від 6-10 до декількох десятків), належать до поліпептидів (пептидний зв’язок позначено кольором):
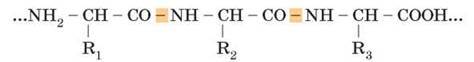
Подальше збільшення цього ланцюга призводить до утворення молекули білка (пептиду).
До речі, деякі амінокислоти організм людини не здатен синтезувати самостійно. Такі амінокислоти називають незамінними. Вони можуть надходити до організму людини лише з їжею. Незамінними амінокислотами є валін, лейцин, ізолейцин, треонін, лізин, метіонін, фенілаланін, триптофан.
?2.7 Білки (або поліпептиди) – це високомолекулярні полімерні молекули, які складаються із залишків амінокислот. У білках амінокислоти з’єднані між собою за допомогою пептидного зв’язку, що утворюється під час взаємодії між карбоксильною групою однієї амінокислоти й аміногрупою іншої. До складу білків живих організмів входять двадцять амінокислот.
За складом білки можна розділити на дві великі групи – прості та складні. Прості білки містять у своєму складі лише амінокислоти, а до складу складних входять ще й небілкові компоненти. Простими білками є, наприклад, альбуміни, глобуліни й гістони. До складних відносять глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, металопротеїни тощо.
Молекули білків відрізняються складною просторовою структурою, в якій виділяють чотири рівні організації. Первинна структура білків обумовлена кількістю й порядком розташування амінокислот у поліпептидному ланцюзі. Карбоксильні й аміногрупи амінокислот у поліпептидному ланцюзі регулярно повторюються. Це дозволяє їм взаємодіяти між собою, утворюючи водневі зв’язки. Ці зв’язки певним чином змінюють положення у просторі окремих ділянок поліпептидного ланцюга, створюючи вторинну структуру білкової молекули у вигляді спіральних або складчастих ділянок. Різні спіральні та складчасті ділянки білкової молекули також взаємодіють між собою. Це відбувається за допомогою гідрофобних чи електростатичних взаємодій між ними або внаслідок утворення водневих чи навіть ковалентних зв’язків між окремими радикалами амінокислот. Таким чином виникає третинна структура білка. Четвертинна ж структура білка виникає внаслідок об’єднання кількох білкових молекул у єдиний структурно-функціональний комплекс (рис.2.3).
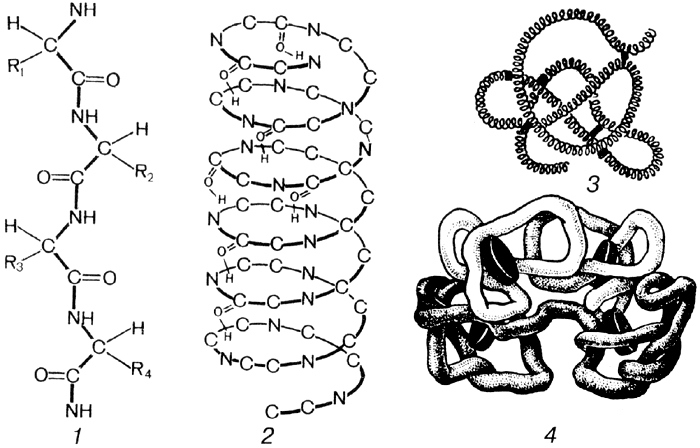
Рис. 2.3 Рівні структурної організації білка: 1 – первинна; 2 – вторинна;
3 – третинна; 4 – четвертинна (на прикладі гемоглобіну крові)
Саме особлива просторова структура дозволяє білкам виконувати більшість їх функцій. Розташування різних типів амінокислотних радикалів в одній точці простору створює унікальні умови для перебігу біохімічних реакцій, а складчасті ділянки білкового ланцюга виявляють значну стійкість до впливу зовнішніх факторів.
Дата публикования: 2015-09-18; Прочитано: 3694 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
