 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Функції білків
|
|
| Група білків | Функції | Приклади |
| Структурні білки | Є компонентами опорних структур і покривів. Входять до складу сполучних тканин. Беруть участь в утворенні скелета, зв’язок, шкіри, пір’я, шерсті та інших похідних епідермісу | Колаген, кератин, еластин, мукопротеїни |
| Ферменти | Є каталізаторами біохімічних реакцій. Забезпечують життєдіяльність організму | Трипсин, пероксидаза, алкогольдегідрогеназа |
| Гормони | Регулюють обмін речовин в організмі | Інсулін, глюкагон |
| Транспортні білки | Забезпечують в організмі транспорт кисню, жирних кислот, ліпідів та інших сполук | Гемоглобін, гемоціанін, альбумін |
| Захисні білки | Утворюють комплекси із чужими білками, інактивуючи їх. Беруть участь у процесі зсідання крові | Антитіла, фібриноген, тромбін |
| Скоротливі білки | Забезпечують скорочення м’язів | Актин, міозин |
| Запасні білки | Беруть участь у створенні в організмі запасу речовин, які необхідні для забезпечення подальшої життєдіяльності | Яєчний альбумін, казеїн |
| Токсини | Залежно від способу життя організму, який їх виробляє, можуть слугувати як засобом захисту, так і засобом нападу | Зміїна отрута, дифтерійний токсин |
За формою білкової молекули білки поділяють на три великі групи – фібрилярні, глобулярні та проміжні. Фібрилярні білки складаються з довгих ниткоподібних молекул або складчастих структур. У них слабко виражена третинна структура білка та вони погано розчиняються у воді. Глобулярні білки мають добре виражену третинну структуру й добре розчиняються у воді, їх молекули приймають форму компактних глобул, що й дозволяє їм ефективно виконувати свої функції. Структура проміжних білків є перехідною між глобулярними й фібрилярними формами.
Просторова структура білків може порушуватися під впливом зміни температури, хімічного середовища, фізичних факторів. У цьому випадку спочатку руйнується четвертинна структура, потім третинна, вторинна і, наостанок, первинна, коли розпадається поліпептидний ланцюг. Цей процес називається денатурацією. Вона може бути зворотною, коли після припинення дії денатуруючого фактора білок самостійно відновлює свою структуру, і незворотною, коли після припинення дії фактора відновлення структури білка (або ренатурації) не відбувається.
У зв’язку з великим різноманіттям білків вони в живих організмах виконують багато функцій.
?2.8 Ферменти. Каталітична функція притаманна особливим білкам – ферментам, або ензимам, що впливають на перебіг біохімічних реакцій. Каталіз (від грец. каталіз – припинення) – зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук. Каталітичну функцію в живих організмах - біокаталіз – здійснюють ферменти (рис.2.4).
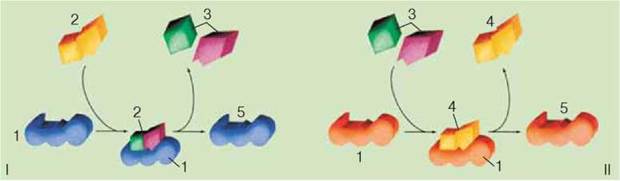
Рис.2.4 Функції ферментів. І. Фермент (1) тимчасово сполучається з речовиною (2) і забезпечує її розщеплення на простіші сполуки (3). ІІ. Фермент (1) вступає у тимчасовий комплекс із двома молекулами (3) і забезпечує їхню реакцію з утворенням складнішої речовини (4). Після реакції структура ферменту не змінюється (5) і він готовий забезпечувати нові реакції
Ферменти бувають простими та складними. Прості ферменти – це білкові молекули (пепсин, трипсин тощо), які складаються лише з амінокислотних залишків. Складні ферменти, крім білкової частини, містять ще й небілкову, яку називають кофактором. Кофакторами можуть бути неорганічні катіони або аніони, а також органічні речовини (коферменти), наприклад похідні вітамінів. Білковий компонент складних ферментів визначає, яку саме реакцію каталізує певний складний фермент. Але активність складних ферментів проявляється лише тоді, коли білкова частина ферменту сполучається з небілковою.
Каталітична активність ферменту зумовлена не всією його молекулою, а лише її невеликою ділянкою – активним центром. Його просторова структура відповідає хімічній будові речовин, які вступають у реакцію. Активний центр відповідає за приєднання та перетворення сполук, що вступають у реакцію. Саме тому дія ферменту специфічна. Часто до складу активного центру входять похідні вітамінів або атоми металів. В одній молекулі ферменту може бути кілька активних центрів.
Ферменти утворюють нестійкі комплекси з речовинами, які вступають у реакцію. Ферментативна реакція перебігає в 106-1012 разів швидше, ніж у середовищі без ферментів. За кілька секунд чи навіть частки секунди в організмі відбувається складна послідовність реакцій, для проведення якої із застосуванням звичайних хімічних каталізаторів потрібні дні, тижні або навіть місяці та роки. Це пояснюють тим, що для здійснення будь-якої хімічної реакції необхідний контакт між реагентами. Аби відбулася реакція без участі ферментів, потрібна висока концентрація реагуючих речовин у середовищі або підвищена температура, за якої прискорюється рух молекул і зростає ймовірність контактів молекул реагуючих сполук. Але в організмах концентрація речовин часто дуже низька, а високі температури можуть бути небезпечними. Саме тому біохімічні реакції не можуть відбуватися без участі ферментів.
При контакті з ферментом речовина, що вступає в реакцію, орієнтується у безпосередній близькості від специфічних груп активного центру ферменту. При цьому зменшується стабільність хімічних зв’язків у її молекулі. Відомо, що для перебігу хімічної реакції молекула субстрату повинна перейти у так званий перехідний стан, коли полегшується розрив хімічних зв’язків. Енергію, необхідну для переходу субстрату в активований стан, називають енергією активації (на розрив певного зв’язку витрачається енергії не менше, ніж витрачено на його утворення). Іншими словами, енергія активації – це енергія, потрібна для того, щоб розпочалася відповідна хімічна реакція. Утворюючи комплекс «фермент-речовини, які вступають у реакцію», ферменти знижують енергію активації. Такий комплекс швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому не втрачає своєї активності і може каталізувати наступну подібну реакцію.
Одні ферменти забезпечують розщеплення певних сполук, інші – синтез. Наприклад, фермент целюлаза забезпечує розщеплення клітковини (целюлози). Якщо в реакції беруть участь дві сполуки або більше, кожна з них взаємодіє з ферментом. Фермент при цьому утримує їх близько одна від одної, забезпечуючи реакцію.
Активність ферменту проявляється лише за певних умов: тих чи інших значень температури, тиску, рН тощо. Існують і спеціальні речовини, здатні регулювати активність ферментів. Вони зв’язуються з активними центрами ферментів і блокують їхню активність. У ролі таких речовин – інгібіторів можуть виступати іони важких металів: Плюмбуму (Pb), Арсену (As), Аргентуму (Ag).
Ферментативні реакції відбуваються у вигляді низки послідовних етапів (до декількох десятків). Ланцюги взаємопов’язаних ферментативних реакцій загалом забезпечують обмін речовин і перетворення енергії в окремих клітинах й організмі в цілому.
Ферменти мають певне розташування як у межах окремої клітини, так і в організмі в цілому. У клітині багато ферментів пов’язані з плазматичною мембраною або мембранами окремих органел (мітохондрій, пластид тощо).
?2.9 Нуклеїнові кислоти – це лінійні біополімери, мономерами яких є нуклеотиди.
Нуклеотиди складаються з моносахариду пентози (рибоза в молекулах РНК і дезоксирибоза в молекулах ДНК), залишку фосфатної кислоти й азотистої основи (рис.2.5).
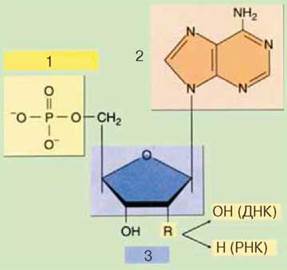
Рис.2.5 Будова нуклеотиду: 1 – залишок ортофосфатної кислоти;
2 – нітратна основа; 3 – моносахарид (пентоза)
З цих основ до складу РНК входять аденін (А), гуанін (Г), урацил (У) і цитозин (Ц), а до складу ДНК – аденін (А), гуанін (Г), тимін (Т) і цитозин (Ц). Крім того, що нуклеотиди є мономерами нуклеїнових кислот, вони відіграють роль коферментів, без яких не може працювати цілий ряд важливих ферментів.
Ще одна функція нуклеотидів – утворення макроергічних сполук шляхом приєднання залишків ортофосфатної кислоти. Саме в такій формі зберігається і використовується енергія, яку отримують з їжею чи виробляють шляхом фотосинтезу чи хімічних реакцій живі організми. Циклічні форми нуклеотидів відіграють важливу роль у регуляції цілого ряду процесів у клітинах та організмі в цілому.
Нуклеїнові кислоти у живих організмах вони представлені рибонуклеїновими (РНК) та дезоксирибонуклеїновими (ДНК) кислотами. У більшості випадків ДНК мають вигляд подвійного полінуклеотидного ланцюга (рис.2.6).
Нуклеотиди ДНК містять у своєму складі дезоксирибозу й одну з чотирьох основ – аденін (А), гуанін (Г), тимін (Т) або цитозин (Ц). Дві нитки ДНК з’єднані між собою водневими зв’язками, утвореними основами, які входять до складу нуклеотидів. Такі зв’язки можуть утворювати лише певні пари: гуанін із цитозином, а аденін – із тиміном. Водневі зв’язки між іншими компонентами нуклеотидів надають молекулі ДНК форму спіралі.
Основна функція ДНК – зберігання і відтворення спадкової інформації та передача її нащадкам. Здійснюється це завдяки процесам реплікації та транскрипції. У ході реплікації спеціальні білки-ферменти розплітають ДНК на одинарні нитки. Після цього інші ферменти на кожній з ниток добудовують її дзеркальну копію, розміщаючи тимін навпроти аденіну, а гуанін – навпроти цитозину.
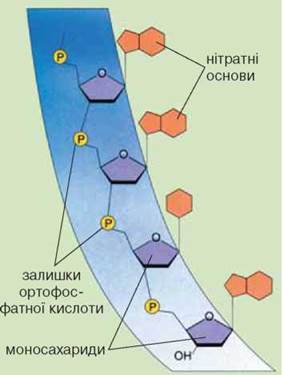
Рис.2.6 Схема будови нуклеїнової кислоти
Таким чином організм отримує дві однакові копії ДНК, які можна розподілити між дочірніми клітинами після поділу материнської клітини.
Дата публикования: 2015-09-18; Прочитано: 2580 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
