 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реакционная способность алканов
|
|
Алканы – насыщенные углеводороды. Все атомы углерода в их молекулах sp3-гибридизованы.
Первые представители гомологического ряда алканов (с неразветвлённой цепью):
| CH4 метан CH3-CH3 этан CH3-CH2-CH3 пропан CH3-(CH2)2-CH3 бутан CH3-(CH2)3-CH3 пентан | CH3-(CH2)4-CH3 гексан CH3-(CH2)5-CH3 гептан CH3-(CH2)6-CH3 октан CH3-(CH2)7-CH3 нонан CH3-(CH2)8-CH3 декан |
Для того, чтобы определить, какой тип реакций наиболее характерен для алканов, нужно рассмотреть электронное строение алкана (на примере этана).
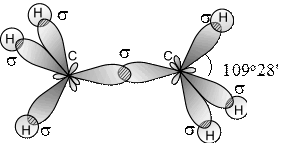 Атомы углерода sp3-гибриди-
Атомы углерода sp3-гибриди-
зованы, валентный угол - 109о28`. C-C-связь образована за счёт линейного перекрывания гибридных орбиталей, т.е. это σ-связь, C-H-связи являются также σ-связями. C-C-связи неполярны, C-H-связи мало полярны. C-H-связи прочнее, чем C-C-связь, т.к. они короче (0,110 и 0,154 нм соответственно).
Так как неполярные и малополярные связи разрываются по гомолитическому (радикальному) типу, для алканов характерны радикальные реакции. Алканы – насыщенные углеводороды, поэтому для них невозможны реакции присоединения, но характерны реакции замещения и отщепления. Наиболее важными реакциями алканов являются реакции радикального замещения (SR).
Типичный пример реакции SR – галогенирование алканов при облучении. Облучение часто используется для избирательного расщепления относительно слабых связей. При этом образующиеся частицы – радикалы выступают в качестве инициаторов последующих превращений.
Рассмотрим механизм реакции хлорирования метана.
 Это схема реакции. Она показывает, какие соединения вступили в реакцию и какие образовались, но не объясняет как это произошло.
Это схема реакции. Она показывает, какие соединения вступили в реакцию и какие образовались, но не объясняет как это произошло.
Описание механизма реакции (совокупности её элементарных стадий) позволяет понять, какие условия необходимы для конкретной реакции, а во многих случаях – какой продукт будет преобладающим.
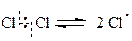 В реакции хлорирования метана под действием ультрафиолетового облучения (энергии кванта света) происходит гомолиз молекулы хлора с образованием свободных радикалов хлора:
В реакции хлорирования метана под действием ультрафиолетового облучения (энергии кванта света) происходит гомолиз молекулы хлора с образованием свободных радикалов хлора:
Это стадия инициирования.
 Следующая стадия реакции – стадия роста цепи. Под действием радикала хлора происходит гомолиз одной из C-H-связей с образованием нового свободного радикала (метил) и молекулы хлороводорода:
Следующая стадия реакции – стадия роста цепи. Под действием радикала хлора происходит гомолиз одной из C-H-связей с образованием нового свободного радикала (метил) и молекулы хлороводорода:
Образовавшийся радикал метил атакует следующую молекулу хлора, расщепляя её на радикалы и образуя молекулу хлорметана и новый радикал хлора и т.д. Таким образом, стадии реакции следуют друг за другом как звенья цепи: конец одной реакции (свободный радикал) является началом следующей, один радикал расходуется, но другой образуется. Поэтому реакции галогенирования алканов называют свободнорадикальными цепнымиреакциями. Отдельные звенья стадии роста цепи могут повторяться сотни раз.
 Если встретятся и провзаимодействуют два свободных радикала, произойдёт обрыв цепи: активные частицы расходуются, а новые не образуются. Например:
Если встретятся и провзаимодействуют два свободных радикала, произойдёт обрыв цепи: активные частицы расходуются, а новые не образуются. Например:
В реакции хлорирования метана нам не нужно решать проблему, по какому положению она протекает, т.к. в молекуле только один атом углерода. При галогенировании пропана в принципе могут получиться два различных продукта, например, 1-бромпропан и 2-бромпропан:
 |
 Чтобы решить вопрос, какой из продуктов будет преобладать, нужно описать механизм данной реакции. Известно, чем стабильнее промежуточная частица реакции (интермедиат), тем больше вероятность её образования. Следовательно, нам необходимо сравнить стабильность двух возможных свободных радикалов, образующихся на стадии роста цепи.
Чтобы решить вопрос, какой из продуктов будет преобладать, нужно описать механизм данной реакции. Известно, чем стабильнее промежуточная частица реакции (интермедиат), тем больше вероятность её образования. Следовательно, нам необходимо сравнить стабильность двух возможных свободных радикалов, образующихся на стадии роста цепи.
Свободные радикалы в целом очень нестабильны, т.к. имеют неспаренный электрон, они «ищут» пару электрону и легко вступают в реакции. Радикал изопропил относительно более устойчив, чем пропил. Это можно объяснить, показав смещение электронной плотности в данных радикалах.
 Изопропил – вторичный радикал. Атом углерода с неспаренным электроном находится в sp2-гибридизации, он более электроотрицателен, чем соседние sp3-гибридизованные атомы. Поэтому электронная плотность смещается к углероду с неспаренным электроном с двух сторон, что способствует стабилизации радикала.
Изопропил – вторичный радикал. Атом углерода с неспаренным электроном находится в sp2-гибридизации, он более электроотрицателен, чем соседние sp3-гибридизованные атомы. Поэтому электронная плотность смещается к углероду с неспаренным электроном с двух сторон, что способствует стабилизации радикала.
 Пропил – первичный радикал. Электронная плотность смещается к углероду с неспаренным электроном с одной стороны. Радикал не столь стабилен, как изопропил.
Пропил – первичный радикал. Электронная плотность смещается к углероду с неспаренным электроном с одной стороны. Радикал не столь стабилен, как изопропил.
Вероятность образования радикала изопропила на стадии роста цепи выше, а значит, в дальнейшем именно радикал изопропил имеет больше шансов прореагировать с новой молекулой брома и образовать конечный продукт реакции – 2-бромпропан.
В целом самыми стабильными являются третичные радикалы, менее стабильными – вторичные, наименее – первичные.
Реакции радикального замещения в алканах являются региоселективными. Региоселективность – это преимущественное протекание реакции по одному из нескольких однотипных реакционных центров. Региоселективность является следствием различной стабильности образующихся свободных радикалов.
Реакция нитрования алканов также протекает по механизму радикального замещения, она также региоселективна. Например, при нитровании 2-метилпропана реакция в первую очередь протекает у третичного атома углерода:
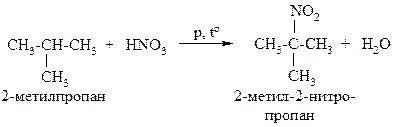 |
Реакцию нитрования проводят разбавленной азотной кислотой при повышенной температуре и давлении. Она известна как реакция Коновалова.
Дата публикования: 2015-09-18; Прочитано: 7869 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
