 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электронное строение элементов-органогенов. Химическая связь в органических молекулах
|
|
Биоорганическая химия изучает строение и свойства соединений, участвующих в процессах жизнедеятельности, во взаимосвязи с их биологическими функциями.
Основные объекты изучения биоорганической химии – это биополимеры (углеводы, пептиды и белки, нуклеиновые кислоты) и биорегуляторы (гормоны, витамины, лекарственные средства).
Биоорганическая химия неразрывно связана с органической химией, т.к. использует её методы и принципы. В основе теории органической химии, сформулированной А.М. Бутлеровым, лежит положение о зависимости свойств соединений от их химического строения и взаимного влияния атомов в молекулах. Это значит, что химические свойства органических соединений обусловлены типом химических связей, природой связываемых атомов и их взаимным влиянием. А это, в свою очередь, определяется электронным строением атомов и взаимодействием их атомных орбиталей.
Рассмотрим электронное строение атомов тех элементов, которые чаще всего встречаются в структуре органических молекул углерода, водорода, азота и кислорода.
Атомная орбиталь – это область пространства вокруг атомного ядра, в которой возможность нахождения электрона максимальна.
Водород – элемент первого периода, следовательно, его внешний электронный уровень представлен только s-орбиталью (она имеет сферическую форму). Углерод, азот и кислород – элементы второго периода, их внешний электронный уровень представлен одной s- и тремя p-орбиталями. Причём эти три p-орбитали характеризуются одинаковой формой (объёмной восьмёрки или гантели), энергией, но отличны ориентацией в пространстве (в трёхмерной системе координат – px, py и pz).
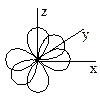
Электронное строение углерода в основном состоянии 1s22s22p2. В возбуждённом состоянии (т.е. при образовании связей) – 1s22s2p3.
В органической химии широко используются представления о гибридных орбиталях. Сущность гибридизации заключается в том, что из нескольких различных орбиталей, близких по энергии, образуется такое же число атомных орбиталей одинаковых по форме и энергии. Гибридные орбитали за счёт большего перекрывания затем образуют более прочные связи по сравнению с негибридными.
Атомы углерода и азота могут находиться в одном из трёх состояний гибридизации – sp3, sp2, sp. Для атома кислорода характерна sp3- и sp2-гибридизация.
 Процесс sp3-гибридизации протекает с участием всех четырёх внешних атомных орбиталей углерода:
Процесс sp3-гибридизации протекает с участием всех четырёх внешних атомных орбиталей углерода:
 Гибридные орбитали равноценны, имеют форму неправильных объёмных восьмёрок и расположены в пространстве под углом 109о28’, т.е. направлены к углам тетраэдра. Поэтому sp3-гибридизованный атом углерода называют тетраэдрическим. У атома углерода на каждой гибридной орбитали присутствует по одному электрону.
Гибридные орбитали равноценны, имеют форму неправильных объёмных восьмёрок и расположены в пространстве под углом 109о28’, т.е. направлены к углам тетраэдра. Поэтому sp3-гибридизованный атом углерода называют тетраэдрическим. У атома углерода на каждой гибридной орбитали присутствует по одному электрону.
 Электронная конфигурация sp3-гибридизованного атома азота отличается тем, что на одной из гибридных орбиталей у него присутствуют два электрона (электронная формула азота 1s22s22p3):
Электронная конфигурация sp3-гибридизованного атома азота отличается тем, что на одной из гибридных орбиталей у него присутствуют два электрона (электронная формула азота 1s22s22p3):
Эту пару электронов называют неподелённой электронной парой, т.к. обычно она не участвует в образовании связей. Валентный угол sp3-гибридизованного азота равен 107о.
 У sp3-гибридизованного атома кислорода (электронная формула – 1s22s22p4) две гибридные орбитали заняты неподелёнными электронными парами и валентный угол равен 104,5о :
У sp3-гибридизованного атома кислорода (электронная формула – 1s22s22p4) две гибридные орбитали заняты неподелёнными электронными парами и валентный угол равен 104,5о :
В sp2-гибридизации участвуют s-орбиталь и две p-орбитали:
 |
 Одна pz-атомная орбиталь остаётся негибридизованной.
Одна pz-атомная орбиталь остаётся негибридизованной.
sp2-атомные орбитали расположены в одной плоскости под углом 120о, а pz-орбиталь – перпендикулярно им.
 |  |



 |  |
 У sp2-гибридизованного атома углерода на каждой орбитали находится по одному электрону:
У sp2-гибридизованного атома углерода на каждой орбитали находится по одному электрону:
Распределение электронов по орбиталям (электронная конфигурация) у sp2-гибридизованного атома азота может быть различным: неподелённая электронная пара может находиться или на sp2-атомной орбитали, или на негибридной pz-орбитали.
 |  | ||
Известны также два типа sp2-гибридизованных атома кислорода: на pz-орбитали может находиться один электрон или неподелённая электронная пара.
 |
В sp-гибридизации участвуют s- и p-атомные орбитали:
 | |||
 | |||

Две гибридные орбитали
расположены под углом
180о.
 Оставшиеся негибридными py- и pz-орбитали расположены перпендикулярно осям гибридных орбиталей и перпендикулярно друг другу:
Оставшиеся негибридными py- и pz-орбитали расположены перпендикулярно осям гибридных орбиталей и перпендикулярно друг другу:
 |
 У sp-гибридизованного атома углерода каждая орбиталь занята одним электроном:
У sp-гибридизованного атома углерода каждая орбиталь занята одним электроном:
 Неподелённая электронная пара sp-гибридизованного азота всегда расположена на одной из гибридных орбиталей:
Неподелённая электронная пара sp-гибридизованного азота всегда расположена на одной из гибридных орбиталей:
Для кислорода sp-гибридизация не характерна.
Очень важно научиться определять тип гибридизации и электронную конфигурацию атомов. Это необходимо для понимания распределения электронной плотности в молекулах, определения электронных эффектов, стабильности молекул и промежуточных частиц. А это, в свою очередь, помогает определить преимущественное направление реакции, сравнить активность различных соединений в той или иной химической реакции.
Как же правильно определить тип гибридизации атомов в молекулах?
Для углерода тип гибридизации определяется по количеству σ-связей. σ-Связи образуются за счёт гибридных орбиталей, значит, сколько σ-связей у углерода, столько и гибридных орбиталей. Например, определим тип гибридизации атомов углерода в молекуле пропена CH2=CH-CH3. Первый атом углерода образовал три σ-связи (одну – с соседним углеродом и две – с двумя атомами водорода), значит, у этого углерода три гибридных орбитали, что соответствует sp2-гибридизации. Второй атом углерода также образовал три σ-связи (две – с двумя соседними атомами углерода и одну – с водородом), т.е. он также находится в sp2-гибридизации. Третий углерод образовал четыре σ-связи, имея четыре гибридных орбитали, т.е. он sp3-гибридизован.
Тип гибридизации атомов азота или кислорода определяется по соседнему углероду, например, в молекуле этиламина CH3-CH2-NH2 азот имеет sp3-гибридизацию так же, как и соседний углерод. В молекуле виниламина CH2=CH-NH2 азот sp2-гибридизован.
 Если вы определили, что азот или кислород в какой-либо молекуле sp2-гибридизован, возникает следующая проблема. Нужно определить его электронную конфигурацию (распределение электронов по орбиталям). Другими словами, нужно определить число электронов на негибридной орбитали. Запомните, что если sp2-гибридизованный азот (или кислород) образовал только одинарные связи, на негибридной орбитали – 2 электрона (неподелённая электронная пара). Если же он образовал двойную связь, на негибридной орбитали – 1 электрон. Например, электронная конфигурация атома азота в молекуле виниламина CH2=CH-NH2 :
Если вы определили, что азот или кислород в какой-либо молекуле sp2-гибридизован, возникает следующая проблема. Нужно определить его электронную конфигурацию (распределение электронов по орбиталям). Другими словами, нужно определить число электронов на негибридной орбитали. Запомните, что если sp2-гибридизованный азот (или кислород) образовал только одинарные связи, на негибридной орбитали – 2 электрона (неподелённая электронная пара). Если же он образовал двойную связь, на негибридной орбитали – 1 электрон. Например, электронная конфигурация атома азота в молекуле виниламина CH2=CH-NH2 :
 а в молекуле имина формальдегида CH2=NH:
а в молекуле имина формальдегида CH2=NH:
Дата публикования: 2015-09-18; Прочитано: 8514 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
