 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Изотермы Ван-дер-Ваальса. Критическое состояние вещества
|
|
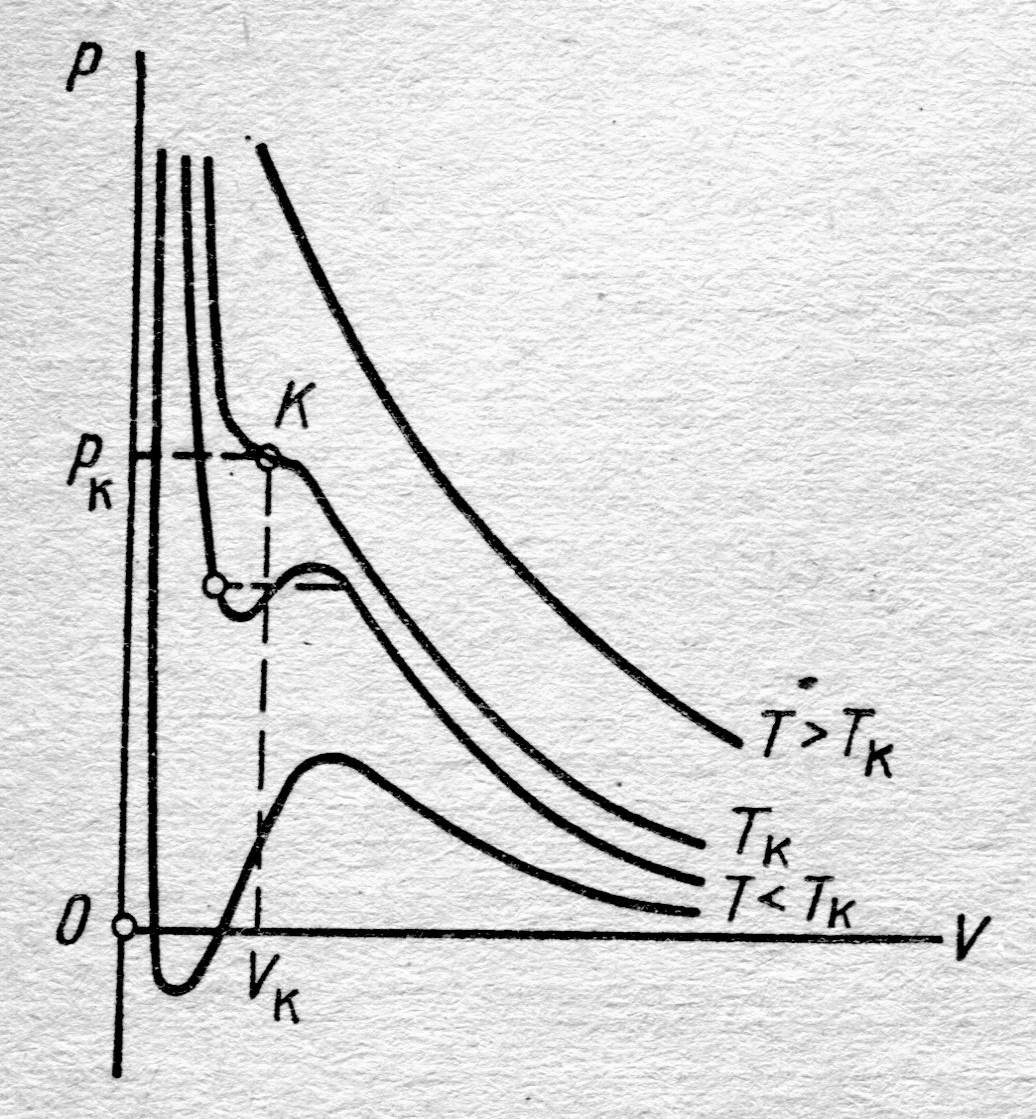
| Рис. 8.3. Изотермы Ван-дер-Ваальса |
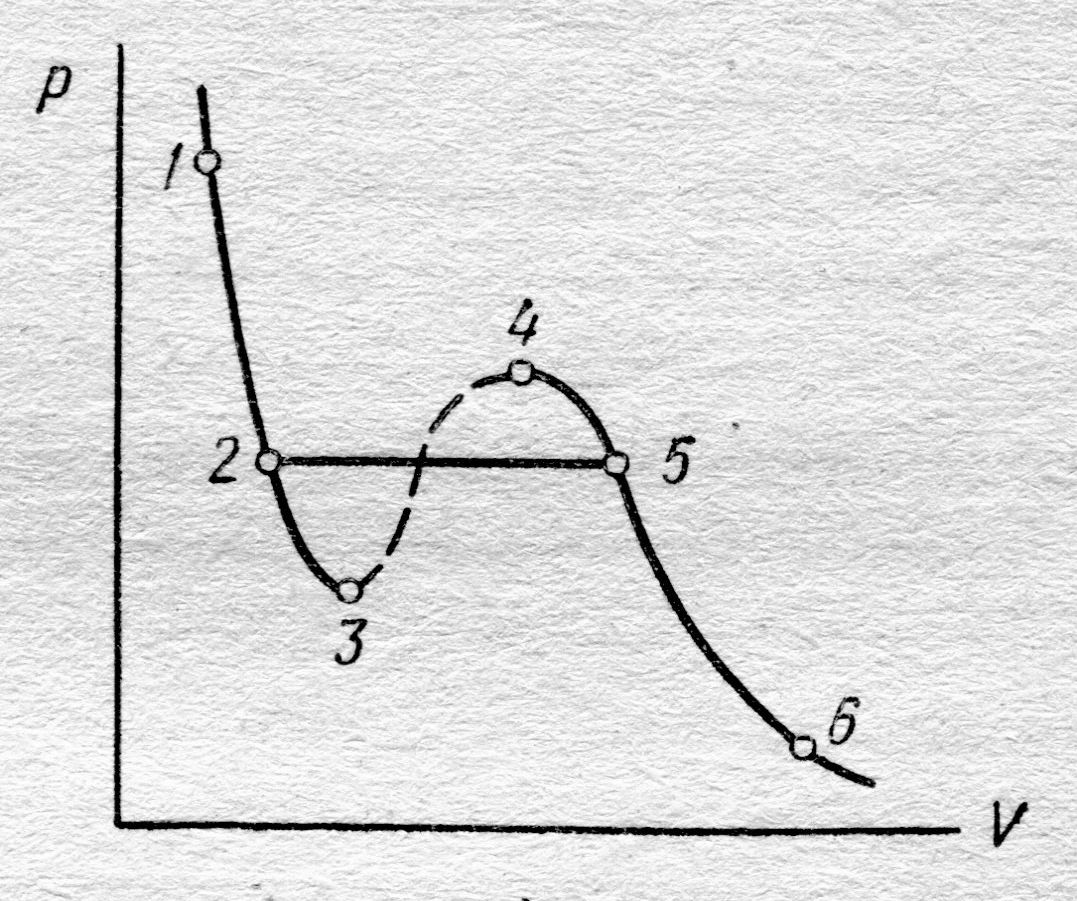
| Рис. 8.4. Пояснения в тексте. |
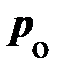
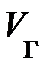
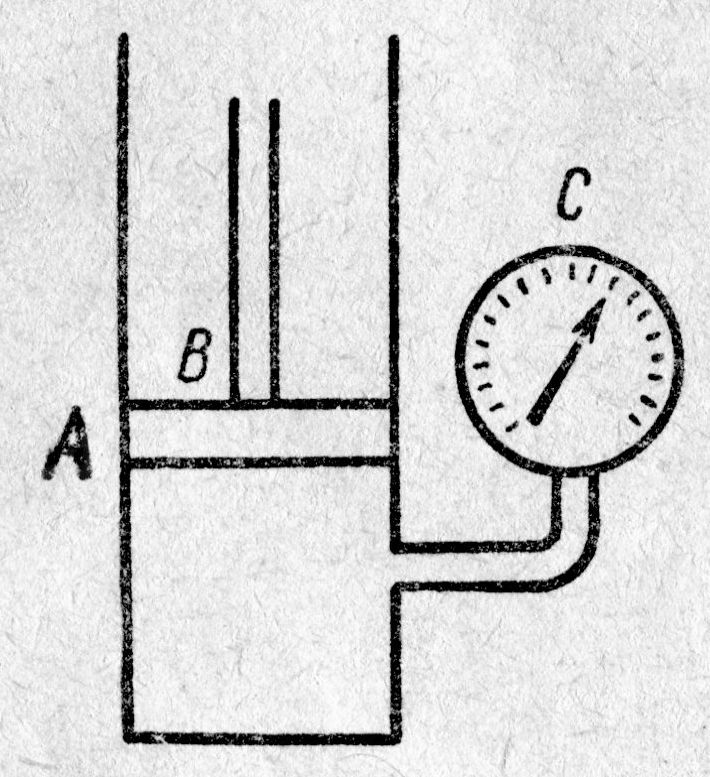
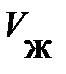 Чтобы выяснить смысл этой, странной на первый взгляд, зависимости, обратимся к опыту. Схема опыта следующая (рис. 8.4): в цилиндре А под поршнем В заключён один моль реального газа, температура которого поддерживается постоянной. Объём реального газа V о может быть измерен по положению поршня В, а его давление – манометром С. На рис. 8.4, сверху, представлена экспериментально полученная изотерма при температуре ниже критической. Измерения показывают, при больших объёмах V о с опусканием поршня В, объём реального газа уменьшается, а давление возрастает монотонно (рис. 8.4., участок изотермы 6®5); свойства реального газа аналогичны свойствам идеального газа.
Чтобы выяснить смысл этой, странной на первый взгляд, зависимости, обратимся к опыту. Схема опыта следующая (рис. 8.4): в цилиндре А под поршнем В заключён один моль реального газа, температура которого поддерживается постоянной. Объём реального газа V о может быть измерен по положению поршня В, а его давление – манометром С. На рис. 8.4, сверху, представлена экспериментально полученная изотерма при температуре ниже критической. Измерения показывают, при больших объёмах V о с опусканием поршня В, объём реального газа уменьшается, а давление возрастает монотонно (рис. 8.4., участок изотермы 6®5); свойства реального газа аналогичны свойствам идеального газа.
При достижении некоторого определённого давления изотерма реального газа идёт не по кривой 5®4®3®2 (рис. 8.4), как этого требует уравнение (8.7), а по изобаре 5®2, т. е. в точке 5 свойства реального газа резко изменяются; происходит расслоение вещества на две фазы: жидкую и газообразную. При дальнейшем опускании поршня давление насыщенного пара p о, начиная с точки 5, остаётся постоянным; начинается процесс конденсации (ожижения) реального газа. Чем дальше опускается поршень, тем  количество газа, который при этих условиях принято называть насыщенным паром, конденсируется в жидкость; переход осуществляется при p о = const (рис. 8.4, 5®2). Точка 2 (рис. 8.4) соответствует переходу всего количества реального газа в жидкую фазу, а ход изотермы примерно следует уравнению (8.7). Под поршнем окажется только жидкость, и дальнейшее продвижение поршня требует весьма значительных усилий.
количество газа, который при этих условиях принято называть насыщенным паром, конденсируется в жидкость; переход осуществляется при p о = const (рис. 8.4, 5®2). Точка 2 (рис. 8.4) соответствует переходу всего количества реального газа в жидкую фазу, а ход изотермы примерно следует уравнению (8.7). Под поршнем окажется только жидкость, и дальнейшее продвижение поршня требует весьма значительных усилий.
Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразные состояния вещества, но охватывает и процесс перехода вещества в жидкость, и процесс её сжатия.
В хорошем соответствии с результатами измерений уравнение Ван-дер-Ваальса показывает сближение точек 5®2, соответствующих объёмам V г и V ж, по мере повышения температуры (рис. 8.4 и 8.3). Горизонтальный участок изотермы сокращается, стягиваясь в точку К. Температура, соответствующая изотерме с точкой К, а вместе с ней объём и давление (рис. 8.3) принято называть критическими – T к, P к, V к. При T к исчезает всякое различие между жидкостью и паром. Предпримем усилия по нахождению взаимосвязи между критическими параметрами состояния T к, P к, Vок для одного моля газа и постоянными а и b уравнения Ван-дер-Ваальса.
Преобразуем уравнение Ван-дер-Ваальса:
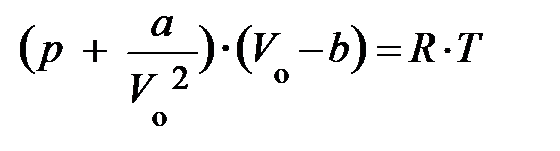 ,
,
раскрыв скобки (выполнили?), умножив левую и правую части на V о2/ р (сделали?) и собрав члены, содержащие V о в одинаковых степенях, приходим к выражению вида:
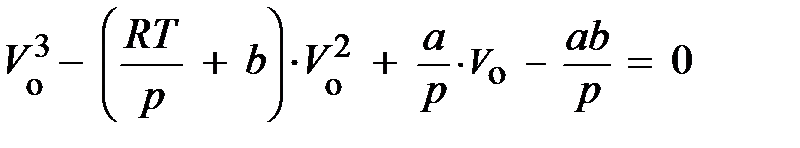 .
.
Отсюда непосредственно следует, уравнение Ван-дер-Ваальса представляет собою уравнение третьей степени относительно V о. Запишем его для критической температуры T к:
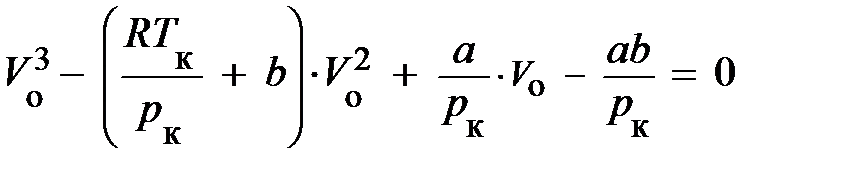 . (8.9)
. (8.9)
Изотерма с температурой T к, рис. 8.3, в точке К имеет перегиб, поэтому в этой точке уравнение (8.9) имеет тройной корень V ок и, как доказывается в алгебре, может быть представлено в виде:
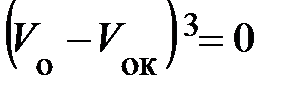 ;
;
если выполнить возведение в степень, то
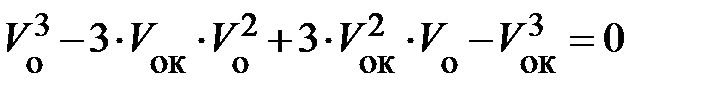 . (8.9а)
. (8.9а)
Оба уравнения (8.9) и (8.9 а) тождественно совпадают между собой, если коэффициенты при одинаковых степенях V о равны, т. е.:
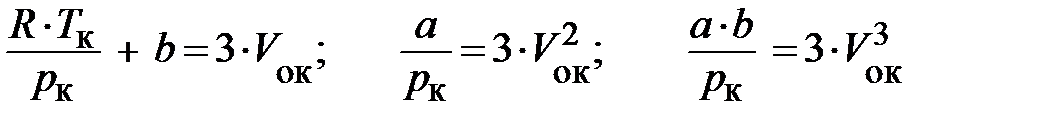 .
.
Решая эти уравнения относительно трёх неизвестных, пытливый читатель, например, разделив последнее равенство на предпоследнее, получит:
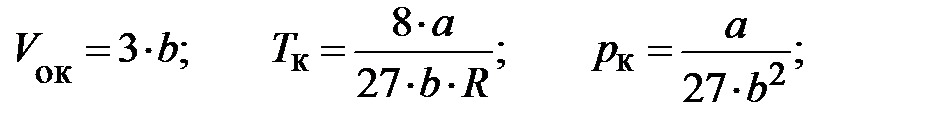
где 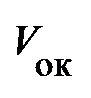 – объём одного моля реального газа при критической температуре.
– объём одного моля реального газа при критической температуре.
В заключение обратим внимание на то, что экспериментальная изотерма 2®5 (рис.8.4) имеет прямолинейный участок вместо завитка 5®4®3®2. Это объясняется неустойчивостью однородных состояний, отвечающих завитку 5®4®3®2.Если пытливый читатель возьмёт производную на участке 3®4 и, проявив терпение, запишет её через приращение, т. е. D р /D V, то убедится, что она положительна(?). Это означает – увеличение объёма сопровождается ростом давления, что, естественно, является противоестественным.
На участках 2®3 и 3®4 D р /D V отрицательна (убедились?), эти участки могут быть реализованы. Однако в силу их неустойчивости (метастабильны) они требуют выполнения соответствующих условий, в частности, исключения посторонних примесей. Участок 5®4 соответствует пересыщенному пару, а 2®3 – перегретой жидкости. Свойства этих состояний нам потребуются в третьем семестре основного курса физики.
Дата публикования: 2015-09-17; Прочитано: 1357 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
