 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реальный газ малой плотности. Понятие об уравнении Ван-Дер-Ваальса
|
|
В предыдущей главе и в работе [3, с. 52; 57] нам удалось достичь некоторого успеха в описании реальных газов малой плотности и при умеренных температурах. Это оказалось возможным благодаря тому, что неизвестный механизм взаимодействия молекул газа при столкновениях нам удалось обойти путём введения его неких средних характеристик (см. § 7.2). Однако с повышением давления и уменьшением температуры наблюдаются значительные отклонения от уравнения состояния идеального газа:
 . (8.1)
. (8.1)
Естественно предположить, причины отступления свойств реальных газов от свойств идеального газа обусловлены простотой модели. В частности, отсутствием учёта собственных размеров молекул и тем, что характер сил взаимодействия между молекулами сложнее, чем для упругих шаров. Было бы неплохо предпринять усилия по уточнению влияния собственных размеров атомов (молекул) и механизма их взаимодействия на результаты исследований свойств реальных газов.
Приступая к рассмотрению одноатомного газа из нейтральных атомов, ограничимся реальными газами малой плотности, когда расстояние между атомами достаточно велико. При таком подходе на эффективное расстояние взаимодействия r о (см. рис. 8.1) одновременно сближается не более двух атомов, что позволяет учитывать только парные взаимодействия и пренебречь взаимодействием трёх и более атомов одновременно. Почему?
Во-первых, нами выбрана система, в составных частях (атомах) которой можно пренебречь внутренним движением и ограничиться только поступательным движением этих объектов. Кроме того, в такой системе возможен переход от фундаментальных кулоновских сил к нефундаментальным межатомным силам взаимодействия. При этом, как показывает эксперимент и теоретические расчёты физиков-теоретиков, характер зависимости энергии взаимодействия нейтральных атомов (молекул) U вз от r при малых расстояниях между ними, r ®0, подчиняется зависимости вида: U вз ~ r – n с n @ 12; т. е. может быть прописано как взаимодействие ионов. Причина здесь кроется в том, что характер сил отталкивания при r ®0 определяется ядрами атомов. Поэтому эти силы практически нечувствительны к тому, какие именно объекты сближаются – ионы или нейтральные атомы [2].

| Рис. 8.1. Форма энергии взаимодействия между двумя атомами. Здесь d = 2rат, r0 @ (3¸4)d – эффективное расстояние взаимодействия |
 ) энергия взаимодействия между ними подчиняется зависимости вида: U вз ~ – r –m с m > 1, т.е. при больших расстояниях r между атомами могут возникать силы притяжения. Причиной здесь может выступать несимметричность в распределении зарядов в атоме или молекуле; типичным примером является молекула воды. В других атомах (молекулах) выбранной системы такое разделение зарядов может возникать под влиянием «соседей». В результате полной компенсации кулоновских сил взаимодействия не происходит, что и объясняет происхождение сил притяжения.
) энергия взаимодействия между ними подчиняется зависимости вида: U вз ~ – r –m с m > 1, т.е. при больших расстояниях r между атомами могут возникать силы притяжения. Причиной здесь может выступать несимметричность в распределении зарядов в атоме или молекуле; типичным примером является молекула воды. В других атомах (молекулах) выбранной системы такое разделение зарядов может возникать под влиянием «соседей». В результате полной компенсации кулоновских сил взаимодействия не происходит, что и объясняет происхождение сил притяжения.Физики на опыте с инертными газами установили, что, несмотря на симметричность расположения электрических зарядов в них, полное выражение для энергии взаимодействия двух нейтральных атомов, справедливое при любом r, имеет вид:
 . (8.2)
. (8.2)
Взаимодействие, энергия которого подчиняется зависимости вида (8.2), называется взаимодействием Ван-Дер-Ваальса.
Во-вторых, межатомные силы взаимодействия приближённо удовлетворяют закону независимости действия сил, так что энергия взаимодействия в нашей системе атомов равна сумме энергий взаимодействия всех парных частиц и может быть представлена в виде:  , что сближает межатомные силы взаимодействия с фундаментальными силами; здесь множитель ½ компенсирует наличие одинаковых вкладов
, что сближает межатомные силы взаимодействия с фундаментальными силами; здесь множитель ½ компенсирует наличие одинаковых вкладов  .
.
В-третьих, при r ®  силы притяжения (8.2) склонны к быстрому исчезновению (рис. 8.1), что сопровождается значительным уменьшением числа частиц одновременно взаимодействующих.
силы притяжения (8.2) склонны к быстрому исчезновению (рис. 8.1), что сопровождается значительным уменьшением числа частиц одновременно взаимодействующих.
Оценим влияние взаимодействия атомов газа на его параметры в тепловом равновесии. Естественно ожидать, силы отталкивания препятствуют сближению двух атомов на бесконечно близкое расстояние. Это указывает на то, что эффективный объём газа V эфф меньше объёма V занимаемого газом (V эфф < V). Силы притяжения (рис. 8.1) должны влиять на давление реального газа; и прежде всего, влияние существования этих сил испытывают атомы вблизи стенки сосуда. Действительно, под воздействием этой силы, направленной внутрь газа, уменьшается концентрация атомов у стенки. В работе [3, с. 52] эту уменьшенную передачу импульса мы интерпретировали в среднем как давление газа.
Под воздействием сил притяжения атомов их концентрация в пристеночном слое убывает. Согласно формуле Больцмана [3, с. 59] в «среднем поле», действующем на один атом газа, она изменяется по закону вида:
 ; здесь n ст. – плотность газа у стенки сосуда при r > d, (рис. 8.2 и 8.1). Если учесть, что n внут. º n о выразим неизвестную концентрацию n ст.(х) атомов у стенки через известную кон
; здесь n ст. – плотность газа у стенки сосуда при r > d, (рис. 8.2 и 8.1). Если учесть, что n внут. º n о выразим неизвестную концентрацию n ст.(х) атомов у стенки через известную кон 





| Рис. 8.2. Концентрация атомов в пристеночном слое |
 центрацию атомов внутри сосуда n о, т. е.
центрацию атомов внутри сосуда n о, т. е.  ; здесь введена более удобная координата х, перпендикулярная стенке сосуда и отсчитываемая от неё. Из рис. 8.2; 8.1 следует, что концентрация атомов у стенки n ст.(х) отличается от n о только в слое от d до r о, при этом n ст.(х) < < n о (рис. 8.2); т. е. концентрация в пристеночной области изменяется лишь в области эффективного взаимодействия d < х < r о. Кроме того, в формуле Больцмана требует уточнения понятие «среднего поля», обозначаемое символом
; здесь введена более удобная координата х, перпендикулярная стенке сосуда и отсчитываемая от неё. Из рис. 8.2; 8.1 следует, что концентрация атомов у стенки n ст.(х) отличается от n о только в слое от d до r о, при этом n ст.(х) < < n о (рис. 8.2); т. е. концентрация в пристеночной области изменяется лишь в области эффективного взаимодействия d < х < r о. Кроме того, в формуле Больцмана требует уточнения понятие «среднего поля», обозначаемое символом  .
.Учёт только парных взаимодействий позволяет записать энергию взаимодействия N атомов в виде:  , где
, где  – энергия взаимодействия для двух атомов, а штрих над суммой означает, что член с i = j отсутствует. Поскольку в качестве переменной
– энергия взаимодействия для двух атомов, а штрих над суммой означает, что член с i = j отсутствует. Поскольку в качестве переменной  мы выбираем энергию взаимодействия
мы выбираем энергию взаимодействия  – на расстоянии эффективного взаимодействия (рис. 8.1), то все члены суммы окажутся одинаковыми. И тогда с учётом того, что N >> 1:
– на расстоянии эффективного взаимодействия (рис. 8.1), то все члены суммы окажутся одинаковыми. И тогда с учётом того, что N >> 1:  . Отсюда немедленно следует, мы можем ввести «среднее поле», действующее на один атом нашей системы
. Отсюда немедленно следует, мы можем ввести «среднее поле», действующее на один атом нашей системы  . И концентрация вблизи стенки сосуда запишется:
. И концентрация вблизи стенки сосуда запишется:  . Здесь необходимо воспользоваться приближением
. Здесь необходимо воспользоваться приближением  <<
<<  , что соответствует малым отклонениям от идеального газа. Кроме того, это позволяет разложить в ряд экспоненциальный множитель, что и сделано в последней формуле n cт.(x). Теперь величину давления, наблюдаемую на опыте в области пространства от d до r o (рис. 8.2), можно записать в виде:
, что соответствует малым отклонениям от идеального газа. Кроме того, это позволяет разложить в ряд экспоненциальный множитель, что и сделано в последней формуле n cт.(x). Теперь величину давления, наблюдаемую на опыте в области пространства от d до r o (рис. 8.2), можно записать в виде:
p º p ср.(d) = n о× k×T – n о×  . (8.3)
. (8.3)
Второй член в этой формуле характеризует внутреннее давление, обусловленное притяжением атомов; в идеальном газе он отсутствует.
Предпримем теперь усилия по осознанию смысла  для реального газа малой плотности. Почему? В идеальном газе мы атомы считали точечными и
для реального газа малой плотности. Почему? В идеальном газе мы атомы считали точечными и  = N / V. Однако наличие сил отталкивания при r < d (см. рис. 8.1) позволяет заключить – это эффективная плотность атомов. Иначе говоря, N атомов могут занимать не весь объём V, а только ту его часть, назовём её эффективным объёмом V эф, которая ещё не занята атомами; во внутренние области друг друга атомы проникнуть не могут. Другими словами,
= N / V. Однако наличие сил отталкивания при r < d (см. рис. 8.1) позволяет заключить – это эффективная плотность атомов. Иначе говоря, N атомов могут занимать не весь объём V, а только ту его часть, назовём её эффективным объёмом V эф, которая ещё не занята атомами; во внутренние области друг друга атомы проникнуть не могут. Другими словами,
 ,
,
где  – собственный объём атомов. Поскольку мы имеем дело с газом малой плотности,
– собственный объём атомов. Поскольку мы имеем дело с газом малой плотности,  << V, и, разлагая в ряд
<< V, и, разлагая в ряд  @ (
@ ( ), приходим к уравнению вида:
), приходим к уравнению вида:
 . (8.4)
. (8.4)
Свяжем собственный объём атомов с размерами атома; представим, что атомы – твёрдые шарики. В таком приближении центры прочих атомов не могут попасть внутрь сферы, описанной вокруг центра выбранного шарика (желательно нарисовать образ). Радиус такой сферы «недоступности» равен диаметру атома,  ,а её объём запишется:
,а её объём запишется:
 .
.
Оценивая объём «недоступности» газа в целом, нужно умножить объём недоступности на число их пар N /2, чтобы не учесть дважды каждый атом. В результате объём «недоступности» газа из N атомов равен:
 . (8.5)
. (8.5)
Разумеется, собственный объём атомов равен учетверённому объёму всех атомов лишь при малой плотности и становится непригодным с увеличением плотности газа.
Таким образом, с учётом выражений (8.4) и (8.5) формула давления реального газа (8.3) принимает вид:
 . (8.6)
. (8.6)
Пытливый читатель, проверяя операцию умножения, обнаружит, здесь опущен член, содержащий U эф << k × T в силу его малости, что оговаривалось в конце с. 117.
Принято вводить обозначения:  ,
,  ; если разность последних двух членов формулы (8.6) заменить выражением – а / V 2, то для давления реального газа приходим к выражению вида:
; если разность последних двух членов формулы (8.6) заменить выражением – а / V 2, то для давления реального газа приходим к выражению вида:  . Здесь первый член соответствует давлению идеального газа, а последний член даёт поправку к давлению для реальных газов малой плотности. Следует заметить, как следует из уравнения (8.6), знак поправки «чувствителен» к соотношению между величинами
. Здесь первый член соответствует давлению идеального газа, а последний член даёт поправку к давлению для реальных газов малой плотности. Следует заметить, как следует из уравнения (8.6), знак поправки «чувствителен» к соотношению между величинами  / V и
/ V и  / k×T и, тем самым, «чувствителен» к температуре.
/ k×T и, тем самым, «чувствителен» к температуре.
Итак, если число атомов N равно числу Авогадро N А, то уравнение Ван-дер-Ваальса для одного моля реального газа запишется:
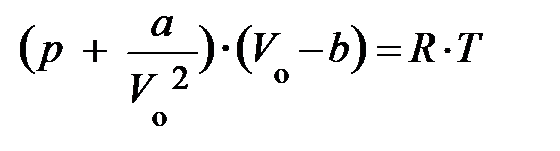 . (8.7)
. (8.7)
Как следует изменить уравнение (8.7), чтобы оно сгодилось для любой массы газа? Настойчивый, а где-то и въедливый, читатель вспомнил понятие моля вещества и представил его на символическом языке: n = = N / N A = N × m 0 / N A× m 0 = m / M = r×V / r × V o. Отсюда немедленно следует V o = = V × M / m, а уравнение (8.7) принимает вид:
 . (8.8)
. (8.8)
В заключение следует сказать, наводящие соображения, приведшие нас к уравнению Ван-дер-Ваальса, не являются его выводом.
Дата публикования: 2015-09-17; Прочитано: 830 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
