 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Направленность ковалентной связи
|
|
Направленность ковалентной связи - результат стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами.
Направленность связи определяет строение молекул веществ, их геометрическую форму: линейную, треугольную, ромбическую, пирамидальную и т.д.
Углы между двумя связями называют валентными.
Рассмотрим структуру некоторых гетероатомных молекул.
4.5.2.1. Структуры молекул сложных веществ (Н2О, NН3)
Структура молекулы воды (H2O) сероводорода (H2S)


Молекула воды состоит из 2-х атомов водорода и одного атома кислорода. Ковалентная связь возникает в результате перекрывания 1s- атомных орбиталей водорода и 2р-орбиталей кислорода (электронная формула O8 1s22s22p4), у которого на р-подуровне есть 2 неспаренных электрона, способных к образованию связи. Угол между р-орбиталями составляет 90о, однако, в результате небольшого расстояния между атомами водорода происходит их отталкивание и угол возрастает до 104,5о, поэтому иногда молекулу воды представляют в виде искаженного тетраэдра. В молекуле сероводорода расстояние между ядрами водорода намного больше и угол между свзями близок к 90о.
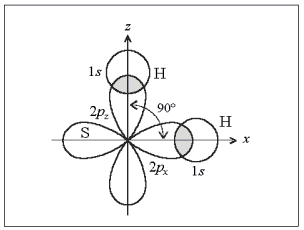
Рис. 4.3. Схема образования молекулы сероводорода Н2S
Дата публикования: 2015-07-22; Прочитано: 2103 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
