 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основные постулаты метода
|
|
В основе теории валентных связей лежит концепция локализованных электронных пар. При образовании химической связи происходит перекрывание орбиталей атомов, образующих связь. Одинарную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам. В результате перекрывания АО между ядрами образуется область с повышенной электронной плотностью, что приводит к притяжению ядер и, соответственно, к понижению энергии системы, т.е. к образованию химической связи. Таким образом, химическая связь является двухцентровой и двухэлектронной.
Связи
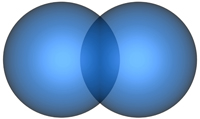
σ-Связь возникает в результате перекрывания атомных орбиталей вдоль оси, проходящей через центры атомов (рис.4.2.1.), то есть между атомами, имеющими неспаренные электроны на s-, p-, или d-орбиталях.
| Рис. 4.2.1. σ-Связи между | ||
| s -орбиталями | p-орбиталями | d-орбиталями |
| 
| 
|
π-Связь (пи-связь) образуется по обе стороны линии σ-связи при боковом перекрывании p- или d-орбиталей (рис.4.2.2.). Максимальное число π-связей равно двум. Они располагаются во взаимно перпендикулярных плоскостях.
| Рис. 4.2.2. π-Связь между | |
| p-орбиталями | d-орбиталями |

| 
|
Кроме π-связей в кратную связь могут входить δ-связи (дельта-связь), которые образуются при перекрывании d-орбиталей четырьмя лопастями (рис. 4.2.3.). Максимальное число δ-связей между двумя атомами равно двум.
Рис. 4.2.3. π-Связь между
d-орбиталями 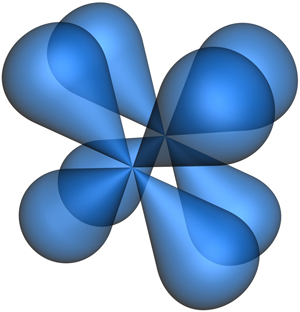
|
Исходя из условий симметрии, следует, что электроны s-орбиталей могут участвовать лишь в σ-связывании, p-электроны – уже в σ- и π-связывании, а d-электроны – как в σ- и π-, так и в δ-связывании. Максимальное перекрывание облаков (наиболее прочная связь) осуществляется при σ-связи.
Дата публикования: 2015-07-22; Прочитано: 1228 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
