 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реальні гази. Рівняння стану реального газу
|
|
· Реальні гази
· Рівняння стану реального газу (рівняння Ван-дер-Ваальса)
· Ізотерма реального газу
Реальні гази. На практиці досить часто доводиться мати справу із реальними газами – наприклад, стиснутими газами в повітряних гальмах, відбійних молотках, компресорах тощо. Досліджені нами властивості газів стосуються ідеального газу – газу, для якого власний об’єм молекул (атомів) і взаємодія між ними не впливають на досліджувані явища. Більшість реальних газів, як уже зазначалось при кімнатній температурі й нормальному атмосферному тиску за своїми властивостями близькі до ідеальних. Проте з підвищенням тиску реальні гази поводять себе по іншому порівняно з ідеальним, зокрема при стисканні, коли суттєво проявляють себе сили міжмолекулярної взаємодії. Щоб описати властивості реальних газів, потрібні інші рівняння, інша модель, ближча за властивостями до реального газу.
Рівняння стану реального газу (рівняння Ван-дер-Ваальса). Задовільною моделлю реального газу, є така, в якій молекули газу мають власний об’єм, їх можна вважати абсолютно пружними кульками між якими діють сили притягання, сили відштовхування проявляють себе у моменти зіткнень.
| Ідеальний газ | Молекули сприймаються як матеріальні точки  d =0 d =0
| Нехтуються сили взаємодії між молекулами

| Співудари між молекулами вважаються абсолютно пружними

|
| Реальний газ | Враховується власний розмір молекул
 d ≠0
d ≠0
| Враховуються сили взаємодії між молекулами
 F ≠0 F ≠0
| Характер співударів між молекулами залежить від конкретних умов
|
На підставі такої моделі голландський фізик Ван-дер-Ваальс запропонував у 1873 р. рівняння стану реального газу. Слід зазначити, що для описання поведінки реальних газів розроблена значна кількість рівнянь. Рівняння Ван-дер-Ваальса є досить простим, але досить точним. Це рівняння Ван-дер-Ваальс отримав із рівняння Менделєєва-Клапейрона, ввівши поправки на розмір молекул і їх взаємодію.
| Ван-дер-Ваальс |
У рівняння Менделєєва-Клапейрона входить об’єм газу, який відповідає об’єму тієї посудини, у якій знаходиться газ. Тобто молекули газу можуть рухатись у всьому наданому їм об’ємі. У реальному газі це не так. Наявність власного об’єму молекул і сил відштовхування зменшують фактичний об’єм, у якому вони можуть вільно рухатись. Об’єм, який може займати газ буде на деяку величину b меншим, її називають поправкою на об’єм молекул.
Теоретичні обчислення показують, що ця поправка у 4 рази більша від сумарного власного об’єму молекул газу. Це зумовлено тим, що сили відштовхування не дають можливості наблизитись молекулами впритул, а лише на відстань, що приблизно дорівнює діаметру молекули.
Дія сил притягання між молекулами призводить до появи у газі додаткового тиску, який називається молекулярним або внутрішнім тиском. У результаті притягання молекул газ ніби стискує сам себе. І хоч він не фіксується манометром, його слід додавати до виміряного значення. Цей тиск пропорційний квадрату густини газу  . Ввівши коефіцієнт пропорційності а (поправку на притягання молекул), який залежить від виду газу, молекулярний тиск становить:
. Ввівши коефіцієнт пропорційності а (поправку на притягання молекул), який залежить від виду газу, молекулярний тиск становить: 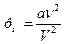 .
.
Підставляючи відповідні поправки до рівняння стану ідеального газу, отримуємо рівняння стану реального газу (рівняння Ван-дер-Ваальса):
 ,
,
де а і b – сталі Ван-дер-Ваальса, які визначаються експериментально і мають різні значення для різних газів.
Рівняння Ван-дер-Ваальса добре описує поводження реальних газів, проте воно теж не зовсім точне, особливо при низьких температурах (коли гази дуже густі).
Ізотерма реального газу. Ізотерми ідеального газу – це гіперболи, бо рівняння Менделєєва-Клапейрона це рівняння першого степеня щодо V.
Перепишемо рівняння Ван-дер-Ваальса у такому вигляді:
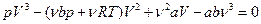 .
.
Як видно, рівняння Ван-дер-Ваальса – це алгебраїчне рівняння третього степеня відносно V. Алгебраїчне рівняння третього степеня з дійсними коефіцієнтами і вільним членом завжди має три розв’язки, але два з них можуть бути комплексними. Оскільки об’єм V є величиною дійсною, то комплексні розв’язки не мають фізичного змісту і існує або одне, або три значення V при одному значенні р.
При T=const теоретично побудована крива залежності об’єму V реального газу від тиску р (ізотерма) є кубічною параболою, її вигляд представлено на мал. 26.

Мал.26. Ізотерма реального газу
Щоб проаналізувати фізичний зміст окремих ділянок побудованої теоретично ізотерми слід дослідити взаємні перетворення рідкого і газоподібного станів речовини.
Дайте відповіді на запитання
1. Чим відрізняються реальні гази від ідеальних?
2. Чим відрізняється модель реального газу від моделі ідеального газу?
3. Напишіть та поясніть рівняння Ван-дер-Ваальса. Який фізичний зміст мають поправки Ван-дер-Ваальса?

| Взаємні перетворення агрегатних станів речовини Молекулярно-кінетична теорія дає змогу не тільки пояснити, чому речовина може перебувати в газоподібному, рідкому і твердому станах, а й пояснити процес переходу речовини з одного стану в інший. До термінів «ідеальний газ», «реальний газ» додається ще термін «пара». Досліджуючи взаємні перетворення рідкого та газоподібного станів з’ясуємо у чому між ними різниця. |
Дата публикования: 2014-10-25; Прочитано: 5971 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
