 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Критичний стан речовини. Зрідженні гази
|
|
· Порівняння дослідної та експериментальної ізотерм
· Зрідження газів
· Критичні параметри
· Практичне використання зріджених газів
Порівняння дослідної та експериментальної ізотерм. У §13 ми зазначили, що теоретично побудована ізотерма реального газу є кубічною параболою (мал. 26), і щоб проаналізувати фізичний зміст окремих ділянок побудованої ізотерми слід дослідити взаємні перетворення рідкого і газоподібного станів речовини.
При дослідженні ізотермічного стискання ненасиченої пари ми отримали графік переходу пари в рідину (мал.27). Такого ж вигляду набуває і графік ізотермічного стискання реального газу при низьких температурах.
Проведемо порівняння теоретично побудованої ізотерми та ізотерми, отриманої при зріджені реального газу. Для цього накреслимо їх на одній координатній площині (мал. 31).
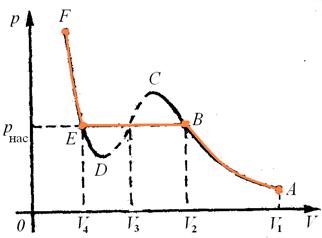
Мал. 31. Теоретична та експериментальна ізотерми
Як видно, ділянки АВ обох ізотерм співпадають. На початку стискання тиск газу змінюється у відповідності із законом Бойля-Маріотта (ділянка АВ). Отже реальний газ і ненасичена пара при невисоких тисках поводить себе однаково.
Ділянки ЕF також співпадають, що відповідає рідкому стану речовини.
Розбіжність між теоретичною і експериментальною ізотермами спостерігається на ділянці ВЕ. Подальше стискання газу приводить до його насичення (т. В на графіку), після чого насичена пара починає конденсуватись (ділянка ВЕ). Процес конденсації відбувається при сталому тиску (ділянка ВЕ паралельна осі V). Теоретична ізотерма має згин ВСDЕ. Спробуємо його пояснити.
Як видно тиск на ділянці ВС більший від тиску насиченої пари. Експериментально це можна отримати, якщо пара буде перенасиченою. Як відомо, тиск перенасиченої пари більший за тиск насиченої пари при даній температурі (оскільки така пара не містить центрів конденсації).
Ділянка ЕD показує, що рідина перебуває під тиском меншим за тиск насиченої пари при даній температурі і не перетворюється у газоподібний стан (не кипить). Це можливо коли рідина є перегрітою (позбавлена центрів пароутворення).
Таким чином, ділянки АВ та ЕF ізотерми Ван-дер-Ваальса відображають стійкі стани ненасиченої пари (газу) і рідини, а ділянки ВС та ЕD – нестійкі стани перенасиченої пари та перегрітої рідини. Ці стани ще називають метастабільними. Достатньо лише пилинки, щоб речовина розпалась на дві фази: рідку і газоподібну.
Ділянка СD – відповідає абсолютно нестійкому стану речовини, в якому тиск мав би зменшуватись із зменшенням об’єму і зростати із його збільшенням. На досліді цей стан не спостерігається.
Проведене порівняння показує, що ділянка згину ВСDЕ ізотерми Ван-дер-Ваальса відповідає перехідному стану речовини з газоподібного стану у рідкий (і навпаки), при цьому передбачає наявність нестабільних станів.
Таким чином, рівняння Ван-дер-Ваальса застосовне як до газоподібного, так і до рідкого стану речовини.
Зрідження газів. Ненасичена пара і реальний газ однаково підпорядковуються рівнянню Ван-дер-Ваальса. Постає питання: чи можливо будь-який газ перевести у стан насичення, а потім у рідину так, як і ненасичену пару?
Ще у ХVІІ ст.. вчені намагались зрідити гази шляхом їх стискання при низькій температурі. Першим газом, який вдалось зрідити, був аміак. Це зробив у 1792 р. голландський учений Ван-Марум, який при температурі 15 оС досяг тиску газу 7,2 атм (приблизно 730 кПа). У 1823 р. М.Фарадею вдалось зрідити хлор. Фундаментальними у цьому напрямку були роботи Д.І.Менделєєва та Ендрюса.
Учений Ендрюс докладно дослідив процес зрідження вуглекислого газу: помістивши газ у скляну трубку, він стискав його ізотермічно при різних температурах. За результатами досліду він побудував сімейство ізотерм (мал. 32).
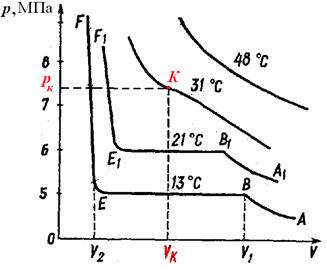
Мал.32. Сімейство ізотерм
Із аналізу ізотерм Ендрюса видно, що якщо при температурі 13 оС і об’єму V 1 газ конденсувався під тиском 5 МПа, то при температурі 21 оС (за іншого значення об’єму) – під тиском 6 МПа.
Чим вище температура, тим меншою є горизонтальна ділянка ВЕ конденсації. І при температурі 31 оС та тиску 7 МПа цей відрізок перетворюється в точку К. При температурах, вищих за критичну, газ не конденсувався. Ізотерми у цьому випадку не мали горизонтальної ділянки і схожі на ізотерми ідеального газу. На основі дослідів Ендрюс зробив висновок, що будь-який газ можна зрідити, якщо він перебуває при температурі нижчій за критичну. При температурі вищій за критичну - газ зрідити не можна, він залишається газом.
Критичні параметри. Проведені дослідження довели, що для кожної речовини існує свій критичний стан, який визначається критичною температурою, тиском і об’ємом.
Теоретично розрахувати критичні параметри газу можна розв’язавши рівняння Ван-дер-Ваальса. Як уже зазначалось це рівняння третього степеня відносно об’єму. Одному значенню тиску відповідає три значення об’єму. При критичному значенні температури всі три корені будуть рівні між собою. Розв’язавши рівняння для цього випадку, визначають критичні параметри газу, взятого у кількості 1 моля:
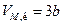 ,
, 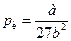 ,
, 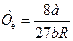 .
.
Критична температура речовини дорівнює тій температурі при якій густина рідини і густина її насиченої пари стають однаковими.
Критичний тиск дорівнює максимальному значенню тиску, який може мати насичена пара даної речовини.
Критичний об’єм є максимальним об’ємом, який може займати речовина у рідкому стані при критичній температурі і тискові.
Співвідношення між критичними параметрами газу набуває вигляду  .
.
Кожен газ має свої критичні параметри, які можна розрахувати або визначити експериментально. Наприклад, для вуглекислого газу Т к=304,1 К, 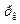 =7,4 МПа, для кисню Т к=154 К,
=7,4 МПа, для кисню Т к=154 К, 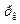 =5,07 МПа, для водяної пари Т к=647 К,
=5,07 МПа, для водяної пари Т к=647 К, 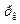 =22 МПа.
=22 МПа.
За допомогою діаграми Ендрюса можна виділити області рівноважного стану речовини (мал. 33). Область Р відповідає рідкому стану речовини, області Г та П відповідають газоподібному стану речовини, а в області Р - П рідка речовина перебуває разом зі своєю парою (двохфазна система).
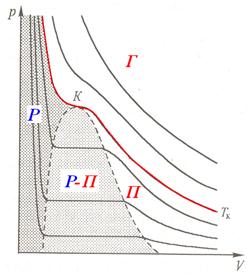
Мал. 33. Області рівноважних станів речовини
Газ і пара різновиди газоподібного стану які відрізняються тим, що пару, яка має температуру нижчу за критичну можна перевести в рідину тільки завдяки збільшенню тиску. Газ має температуру, вищу за критичну і перевести його в рідину шляхом тільки стискання неможна. Його для цього сперш слід охолодити до температури, нижчої за критичну, а потім уже підвищуючи тиск перевести у стан насичення і зрідити.
Практичне використання зріджених газів. Найбільш широкого практичного використання зріджені гази набули у паливній галузі. Так, зріджений нафтовий газ має всі якості повноцінного палива для двигунів внутрішнього згоряння. У всьому світі цей газ визнаний як дешеве, екологічно чисте паливо, по багатьом властивостям переважаючий бензин. Нафтовий газ – це суміш пропану, бутану й незначної кількості (близько 1%) неграничних вуглеводнів.
Природний газ – метан здатний різко зменшувати об’єм (в 600 разів) при його низькотемпературному зрідженні. Такий рідкий газ можна перевозити в спеціальних "бензобаках" при тиску не більше 6 атмосфер (тиск води у водопровідному крані). Продуктами повного згоряння метану є нешкідливі речовини - вуглекислий газ і вода. Саме тому ми не зазнаємо незручностей на наших кухнях, де іноді цілий день горять газові (метанові) плити. Густина природного метану в тисячу разів менша густини бензину.
Пропан-бутан - синтетичне паливо. Його одержують із нафти й сконденсованих нафтових попутних газів. За своїми властивостями зріджений пропан-бутан майже не відрізняється від стислого природного газу.
Особливе місце займає процес зрідження повітря, з якого потім добувають у рідкому стані майже всі гази, що входять до його складу. Це найдешевший спосіб добування рідкого кисню, який широко застосовується в суміші з ацетиленом для автогенного зварювання і різання металів, підземної газифікації вугілля, в металургії кольорових металів, для космічної техніки та ін. Рідкий азот використовується для синтезу аміаку, з якого виробляють мінеральні добрива. У медицині рідкий азот використовують для тривалого зберігання крові, кісткового мозку тощо. Він є кріохірургічним інструментом, за допомогою якого можна локально заморожувати окремі ділянки хворих органів, які потім видаляють.
Дайте відповіді на запитання
1. Який фізичний зміст мають ділянки теоретичної та експериментальної ізотерм?
2. Які процеси характеризують перехід рідин у газоподібний стан і навпаки?
3. Які параметри називаються критичними? Який їх фізичний зміст?
4. У чому полягає відмінність між парою та газом?
5. Наведіть приклади практичного використання зріджених газів.
Дата публикования: 2014-10-25; Прочитано: 5497 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
