 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кондуктометрическое титрование
|
|
Существование линейной зависимости между концентрацией разбавленных растворов электролитов и их электрической проводимостью делает возможным использование кондуктометрии при титровании анализируемого раствора для определения точки эквивалентности.
Кондуктометрическим титрованием называется титриметрический метод анализа, в котором точка эквивалентности определяется по изменению электрической проводимости раствора в ходе титрования.
Кондуктометрическое титрование состоит в том, что к точному объему исследуемого раствора, помещенного в электрохимическую ячейку, добавляют из бюретки равными порциями титрант и после каждого добавления измеряют электрическое сопротивление в ячейке.
При титровании могут протекать различные химические реакции: нейтрализации, осаждения, комплексообразования, окислительно-восстановительные. Общим требованием к ним является достаточно резкое различие в электропроводящих свойствах веществ, присутствующих в системе до и после точки эквивалентности. Наиболее часто это условие выполняется в реакциях нейтрализации.
Зависимость между электрической проводимостью титруемого раствора и добавленным объемом титранта отражается в виде кондуктометрической кривой титрования - графика зависимости 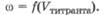 Кондуктометрическая кривая титрования исследуемого раствора одного соединения состоит из двух ветвей, пересекающихся в точке эквивалентности. Характер кривых титрования зависит от силы электролитов, присутствующих в системе, и подвижности их ионов. Рассмотрим несколько примеров.
Кондуктометрическая кривая титрования исследуемого раствора одного соединения состоит из двух ветвей, пересекающихся в точке эквивалентности. Характер кривых титрования зависит от силы электролитов, присутствующих в системе, и подвижности их ионов. Рассмотрим несколько примеров.
 |
1. Титрование сильной кислоты сильным основанием, например раствора НСl раствором NaOH. При титровании протекает реакция:
Как видно из уравнения, до точки эквивалентности идет эквивалентное замещение ионов Н+ на менее подвижные катионы Na+(u°(H+) > u°(Na+)), в результате чего электрическая проводимость раствора уменьшается ( (NaCl) <
(NaCl) <  (HCl)). За точкой эквивалентности электрическая проводимость возрастает (рис. 24.3), что связано, во-первых, с увеличением количества ионов за счет из бытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
(HCl)). За точкой эквивалентности электрическая проводимость возрастает (рис. 24.3), что связано, во-первых, с увеличением количества ионов за счет из бытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
 |
Рис. 24.3. Кривая кондуктометрического титрования сильной кислоты сильным основанием
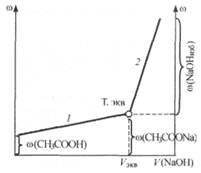 |
Рис. 24.4. Кривая кондуктометрического титрования слабой кислоты сильным основанием
2. Титрование слабой кислоты (СН3СООН) раствором силь
ного основания (NaOH). При титровании протекает реакция:

В данном случае до точки эквивалентности электрическая проводимость возрастает (рис. 24.4), так как по мере титрования молекулы слабодиссоциирующей кислоты замещаются эквивалентным количеством соли - сильного электролита ( (СН3СООNа) > >
(СН3СООNа) > >  (СН3СООН)).
(СН3СООН)).
За точкой эквивалентности проводимость продолжает возрастать, но более резко, что объясняется появлением избытка сильного основания NaOH.
3. Титрование смеси кислот: сильной (НСl) и слабой
(СН3СООН) — раствором сильного основания (NaOH). Так как
присутствие сильной кислоты подавляет диссоциацию слабой, то
электрическая проводимость исследуемого раствора до начала
титрования определяется только содержанием сильной кислоты
и является достаточно высокой. Из-за различия в силе кислот
нейтрализация раствора при титровании протекает в две стадии,
причем сначала нейтрализуется сильная кислота, затем слабая:
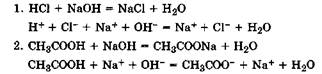
Нейтрализация сильной кислоты на первом этапе титрования (линия 1) ведет к снижению электрической проводимости раствора (рис. 24.5), причины которого уже рассматривались выше. Окончанию первой стадии нейтрализации соответствует точка эквивалентности I. Электрическая проводимость раствора в этот момент определяется содержанием NaCl, вклад слабой кислоты в суммарную проводимость системы очень мал.
На втором этапе титрования, соответствующем нейтрализации СН3СООН и образованию соли CH3COONa (линия 2), электрическая проводимость незначительно повышается, так как кроме ионов соли NaCl в переносе заряда начинают участвовать ионы другой соли - CH3COONa. Окончанию этого этапа титрования отвечает точка эквивалентности И. В этот момент раствор содержит смесь двух солей: CH3COONa и NaCl. Поскольку нейтрализация закончилась, то дальнейшее добавление титранта NaOH приводит к появлению в растворе дополнительного количества ионов, в том числе высокоподвижных ионов ОН", за счет чего электрическая проводимость раствора резко возрастает (линия 3).
 |
Таким образом, кривая титрования смеси сильной и слабой одноосновных кислот содержит три ветви и имеет две точки эквивалентности.
Рис. 24.5. Кривая кондуктометрического титрования смеси сильной и слабой кислот сильным основанием
Кондуктометрическое титрование особенно полезно при работе с окрашенными и мутными растворами, когда употребление индикаторов исключено. Кондуктометрические методы исследования удобны тем, что они, во-первых, являются неразрушающими, во-вторых, характеризуются простотой исполнения и экспрессностью.
Дата публикования: 2014-10-16; Прочитано: 22924 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
