 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Комплексонометрия
|
|
В санитарно-клиническом анализе для количественного определения ионов металлов широко используется комплексонометрия. Комплексонометрия — метод количественного анализа, основанный на реакции комплексообразования с получением прочных хелатных соединений металлов с комплексонами. Комплексонами называются полидентатные лиганды, способные образовывать устойчивые хелатные комплексные соединения. В аналитической практике в качестве комплексона чаще всего используют трилон Б (разд. 10.1), обозначаемый для краткости Na2H2T. Этот 6-дентатный лиганд образует очень устойчивые комплексы с большинством катионов металлов. Метод комплексонометрии на основе трилона Б называется трилонометрией. Наиболее ценным свойством трилона Б является его способность образовывать очень устойчивые бесцветные комплексы с катионами большинства металлов, при этом реакция всегда протекает в соотношении 1: 1 и с вытеснением двух протонов, независимо от заряда катиона металла:

Учитывая обратимость этого взаимодействия, необходимо поддерживать определенное значение рН для обеспечения полного протекания аналитической реакции. Оптимальное значение рН определяется устойчивостью комплекса и растворимостью гидроксида определяемого металла.
Для установления точки эквивалентности в комплексоно-метрии применяют металлоиндикаторы. Особенностями этих индикаторов, точнее их анионов, является способность образовывать с катионом определяемого металла комплекс, окраска которого отличается от окраски свободного аниона индикатора:

Катион определяемого металла в присутствии и аниона индикатора Ind2-, и аниона трилона Б (Н2Т)2- взаимодействует с обоими веществами, но больше с тем, которое образует более устойчивый комплекс:
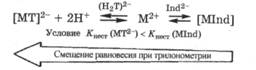
Поэтому, чтобы равновесие было смещено в сторону комплекса с трилоном Б [МТ]-2, его устойчивость должна быть больше, т. е. Kнест (МТ2-) < КнесТ (MInd).
 |
При добавлении к анализируемому раствору индикатор образует вначале комплекс [Mind] и раствор принимает окраску II, характерную для этого комплекса. При добавлении к окрашенному раствору раствора трилона Б он сначала реагирует со свободными ионами анализируемого металла с образованием бесцветного комплекса [МТ]2- и только вблизи состояния эквивалентности происходит разрушение комплекса с индикатором [Mind] в соответствии с реакцией:
 |
В точке эквивалентности окраскараствора резко изменяется (окраска II —> окраска I), так как комплекс с индикатором окончательно исчезает, а в растворе содержатся только свободный индикатор и бесцветный комплекс [МТ]2-. Таким образом, процесс, протекающий при трилонометрическом определении, например, двухзарядного катиона металла,отражают следующие реакции:
Тригонометрия широко используется в санитарно-клиническом анализе для определения содержания ионов кальция, цинка, магния, железа в фармацевтических препаратах, общего кальция (ионизованного, связанного, диффундирующего и недиффундирующего) в сыворотке крови, костях и хрящах, а также при анализе жесткости воды, обусловленной наличием в ней ионов Са2+ и Mg2+.
Суммируя все сказанное о химических превращениях, обеспечивающих метаболизм нашего организма:
- кислотно-основном (обмен протонами);
- окислительно-восстановительном (обмен электронами);
- комплексообразовании (взаимодействие свободных атомных орбиталей комплексообразователя и электронных пар лиганда 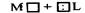 ), следует выделить для них общее. В основе всех этих процессов находится принцип единства и борьбы противоположностей "акцептора - донора", и все они в организме носят в основном обратимый характер, что обеспечивает большинству из них самопроизвольное протекание и способствует поддержанию гомеостаза в организме.
), следует выделить для них общее. В основе всех этих процессов находится принцип единства и борьбы противоположностей "акцептора - донора", и все они в организме носят в основном обратимый характер, что обеспечивает большинству из них самопроизвольное протекание и способствует поддержанию гомеостаза в организме.
Другая особенность всех рассмотренных реакций заключается в том, что они в условиях организма обычно являются электрофильно-нуклеофильными (разд. 15.4).
В кислотно-основных реакциях кислота как донор Н+ выступает электрофилом, а основание - нуклеофилом.
В реакциях комплексообразования комплексообразователь как акцептор электронных пар является электрофилом, а лиганды -нуклеофилами.
В окислительно-восстановительных реакциях окислитель - акцептор электронов - выступает электрофилом, а восстановитель -нуклеофилом. Особенность окислительно-восстановительных реакций заключается в том, что они могут протекать и по свободно-радикальному механизму. В этом случае реагирующая частица с неспаренным электроном - свободный радикал - может быть и акцептором и донором электрона в зависимости от свойств партнера, с которым она взаимодействует. Сравнивая степени окисления атомов в исходных и конечных веществах (а не в радикалах), можно и в этом случае четко определить, что окислитель, а что восстановитель.
 |
Дата публикования: 2014-10-16; Прочитано: 2256 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
