 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Образование комплексных соединений
|
|
Как известно, реакции в растворах всегда протекают в направлении наиболее полного связывания ионов, в том числе за счет образования комплексных соединений, в которых в результате донорно-акцепторного взаимодействия возникает устойчивая внутренняя сфера.
 |
Вследствие образования устойчивых комплексов возможно даже растворение тех осадков, которые посылают в раствор за счет диссоциации растворившейся части вещества крайне небольшое количество ионов, способных с добавленным реагентом образовывать устойчивую внутреннюю сферу комплекса:
 |
Благодаря образованию комплекса происходит связывание молекулы аммиака (газообразного лиганда):
В кислой среде происходит прочное связывание NH3 вследствие образования комплексного иона [NH4]+, а в нейтральной и щелочной среде имеет место конкуренция за прочное связывание катиона водорода между анионом ОН- (Ка = КH2O = 1,8 • 10-16) и молекулой аммиака (Ка =Гнест (NH4(+)) = 5,4 • 10-10). Из сравнения констант соответствующих равновесий видно, что молекула воды удерживает катион Н+ значительно сильнее, чем комплексный ион [NH4]+. Поэтому использовать формулу гидроксида аммония NH4OH некорректно, а следует изображать результат взаимодействия между молекулами воды и аммиака в виде NH3 • Н2О - комплекса-ассоциата (гидрата аммиака). Водный раствор аммиака, называемый в быту "нашатырным спиртом", используется в медицинской практике как источник аммиака и средство скорой помощи для возбуждения дыхания и выведения из обморочного состояния. Таким образом, комплексное соединение возникает в тех случаях, когда донорно-акцепторное взаимодействие комплексообразователя с лигандами приводит к их прочному связыванию с формированием устойчивой внутренней сферы.
Трансформация или разрушение комплексных соединений Трансформация или разрушение комплексного соединения происходит в тех случаях, когда компоненты его внутренней сферы, вступая во взаимодействие с добавленным реагентом, связываются или трансформируются вследствие образования: а) более устойчивого комплекса; б) малодиссоциирующего соединения; в) малорастворимого соединения; г) окислительно-восстановительных превращений. Проиллюстрируем эти положения на примерах.
 |
А. Трансформация комплекса с образованием более устойчивого комплекса в результате:
Рассмотренные реакции трансформации комплексных соединений всегда протекают в сторону образования более устойчивых комплексных соединений, у которых константа нестойкости внутренней сферы меньше, чем у исходных соединений.
Б. Разрушение гидроксокомплексов в кислой среде из-за образования малодиссоциированного соединения Н20:

В. Разрушение комплексного соединения с образованием малорастворимого соединения, в котором комплексообразователь или лиганд связан прочнее, чем в комплексе:

Г. Разрушение или трансформация комплексного соединения в результате окислительно-восстановительных превращений:

Процесс комплексообразования сильно влияет на величины восстановительных потенциалов катионов d-металлов. Если восстановленная форма катиона металла образует с данным лигандом более устойчивый комплекс, чем его окисленная форма, то потенциал возрастает. Снижение потенциала происходит, когда более устойчивый комплекс образует окисленная форма. Иллюстрацией сказанному являются следующие данные.

Эти особенности окислительно-восстановительных свойств ионов "металлов жизни" в биокомплексах очень важны для понимания биохимических процессов, протекающих при их участии (разд. 9.3.3).
Кислотно-основные свойства комплексных соединений
Комплексные соединения могут проявлять кислотно-основные свойства за счет ионов Н+ и ОН- внешней сферы:
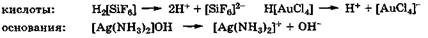
и, кроме того, за счет диссоциации их лигандов. Последнее особенно характерно для природных комплексов, содержащих белки, которые, как известно, являются амфолитами. Например, гемоглобин (ННb) или оксигемоглобин (ННb02) проявляют кислотные свойства за счет кислотных групп белка глобина, являющегося лигандом (разд. 10.4):

В то же время анион гемоглобина за счет аминогрупп белка глобина проявляет основные свойства и поэтому связывает кислотный оксид С02 с образованием аниона карбаминогемогло-бина (НbС02)-: 
С помощью этого соединения С02 транспортируется из тканей в легкие, где, вступая в реакцию с более сильной кислотой окси-гемоглобином, превращается в слабую нестойкую кислоту ННbС02, распадающуюся на гемоглобин с выделением С02:

Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов.
Дата публикования: 2014-10-16; Прочитано: 3046 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
