 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства комплексных соединений
|
|
Диссоциация в растворах
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения -это распад комплексного соединения в растворе на комплексный ион внутренней сферы и ионы внешней сферы.
В водных растворах первичная диссоциация комплексных соединений связана с разрывом в них ионной связи, и поэтому она практически необратима и ее уравнение следует записывать так:

Возникающий в результате первичной диссоциации подвижный комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. Так, в водных растворах [Ag(NH3)2]Cl не удается обнаружить присутствие катионов Ag+ и молекул NH3, в растворах K4[Fe(CN)6] - катионов Fe2+ и анионов CN-, а в растворах [Pt(NH3)4Cl2]Cl2 обнаруживается присутствие только двух моль-эквивалентов анионов хлора.
Вторичная диссоциация комплексного соединения - это распад внутренней сферы комплекса на составляющие ее компоненты.
Вторичная диссоциация связана с разрывом ковалентной связи, поэтому она сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов. Отрыв лигандов из внутренней сферы комплексного иона происходит ступенчато:

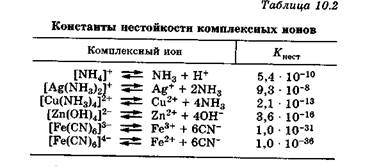
Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия, причем каждая стадия имеет свою константу. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса Кнест. Для комплексного иона [Ag(NH3)2]+ выражение константы нестойкости имеет вид:

Чем меньше Кнест, тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе. Значения Кнест комплексных соединений, приведенные в табл. 10.2, свидетельствуют о том, что в результате процесса комплексообразования происходит очень прочное связывание ионов в водных растворах, особенно ионов комплексообразователей. Следовательно, для связывания ионов из раствора можно чрезвычайно эффективно использовать реакцию комплексообразования.
 |
Особенно эффективное связывание ионов комплексообразова-теля происходит при реакции с полидентатными ("многозубыми") лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру. Образно говоря, ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака. В связи с этим такие комплексные соединения получили названия хелатов.
Хелаты - устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры.
Простейшими хелатообразующими лигандами являются бидентатные лиганды, образующие две связи с центральным атомом, например аминоуксусная кислота (глицин):

Одними из наиболее эффективных хелатообразующих лигандов являются этилендиаминтетрауксусная кислота (EDTA) или ее динатриевая соль, называемая трилон Б:

EDTA образует устойчивые комплексы практически с катионами всех металлов, за исключением щелочных, поэтому EDTA широко используется в аналитической практике для определения содержания ионов различных металлов, а в медицине - в качестве детоксиканта для выведения из организма ионов тяжелых металлов в виде растворимых комплексов.
Среди природных лигандов следует выделить макроциклические полидентатные лиганды, внутри которых размещается комплексообразователь. Макроциклическими лигандами являются порфирины, близкие им по структуре коррины, а также белки. В этом случае лиганд называется "хозяин", а комплексообразователь - "гость". В таких комплексах комплексообразователь изолирован от окружающей среды и может удерживаться прочно, например в гемоглобине, цитохромах, витамине B12, хлорофилле, или слабо, например в ионофорах, используемых для транспорта катионов металлов через мембраны (разд. 10.4).
В природе встречаются полиядерные комплексные соединения. Для них характерно наличие во внутренней сфере нескольких комплексообразователей как одного вида (например, железо в железосеропротеинах [FexSxProt]), так и разных (например, в цитохромоксидазе содержатся одновременно катионы железа и меди). Таким образом, состав, структура и прочность внутренней сферы природных комплексных соединений чрезвычайно разнообразны, и поэтому они могут выполнять различные функции в живых системах (разд. 10.4).
Дата публикования: 2014-10-16; Прочитано: 3867 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
