 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Первый закон термодинамики
|
|
Первый закон (первое начало) термодинамики - это всеобщий закон природы, закон сохранения и превращения энергии, соответствующий основному положению диалектического материализма о вечности и неуничтожимости движения. Впервые этот закон в 1842 г. сформулировал выдающийся немецкий физик Ю. Мейер, врач по образованию.
Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
В зависимости от вида системы первый закон термодинамики имеет различные формулировки.
В изолированной системе внутренняя энергия постоянна, т. е.  U = 0.
U = 0.
Для закрытой системы этот закон термодинамики устанавливает связь между теплотой, полученной или выделенной системой в некотором процессе, изменением внутренней энергии системы и произведенной при этом работой.
Если к закрытой системе подвести теплоту Q, то эта энергия расходуется на увеличение внутренней энергии системы. AU и на совершение системой работы против внешних сил окружающей среды: Q =  U + А.
U + А.
 |
В изобарно-изотермических условиях, в которых функционируют живые организмы, совершаемая работа А = p
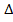 V, тогда
V, тогда
Сумму внутренней энергии системы и произведения объема на давление (U + pV) называют энтальпией (Н).
Энтальпия - термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях.
Теплота, полученная системой при р,Т = const, равна приращению энтальпии системы АН:

Абсолютное значение энтальпии для любой системы определить невозможно, как и абсолютную величину внутренней энергии, поэтому в термодинамических расчетах используют лишь изменения энтальпии АН, происходящие при переходе системы из одного состояния в другое. Величина АН не зависит от пути процесса, а определяется, как для любой другой функции состояния, разностью энтальпий, характеризующих конечное и начальное состояния системы:

Химические реакции и физико-химические процессы могут протекать с выделением и поглощением энергии.
Количество теплоты, которое выделяется или поглощается при проведении химических реакций в изобарно-изотермических условиях, характеризуется изменением энтальпии системы и называется энтальпией реакции  Нр.
Нр.
Химические реакции и физико-химические процессы подразделяются на экзотермические и эндотермические.
Экзотермические процессы сопровождаются выделением энергии из системы в окружающую среду.
В результате таких процессов энтальпия системы уменьшается (H кон < Ннач), следовательно, для экзотермических процессов:

Эндотермические процессы сопровождаются поглощением энергии системой из окружающей среды.
В результате этих процессов энтальпия системы увеличивается H кон > Ннач), следовательно, для эндотермических процессов:

Энтальпия системы является экстенсивным параметром и зависит от количества вещества, температуры и давления, поэтому изменение энтальпии в результате химической реакции или других процессов определяют при стандартных условиях.
Стандартные условия: количество вещества - 1 моль; давление - 760 мм рт. ст. = 101325 Па; температура - 298 К = 25 "С.
Термодинамические параметры, функции или их изменения, измеренные при стандартных условиях, обозначаются соответствующим символом с верхним индексом "°". Стандартную энтальпию реакции обозначают  , кДж/моль.
, кДж/моль.
Стандартная энтальпия реакции представляет собой энергетическую характеристику химической реакции, проводимой в стандартных условиях. Химические уравнения, для которых указано значение энтальпии реакции, называются термохимическими уравнениями. Например, для реакции горения 1 моль ацетилена:
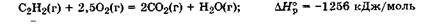
В термодинамике для оценки энергетического состояния веществ используются значения стандартных энтальпий образования этих веществ, обозначаемые  H°(вещество (агрегатное состояние)), кДж/моль
H°(вещество (агрегатное состояние)), кДж/моль
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Например, для кислорода  H°(02) = 0, для графита
H°(02) = 0, для графита  H°(Сграфита) = 0. Однако стандартная энтальпия образования озона
H°(Сграфита) = 0. Однако стандартная энтальпия образования озона  Н°(O3) = = 142,2 кДж/моль, алмаза
Н°(O3) = = 142,2 кДж/моль, алмаза  Н°(алмаз) = 1,8 кДж/моль.
Н°(алмаз) = 1,8 кДж/моль.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
Например, стандартная энтальпия образования этанола равна стандартной энтальпии гипотетической реакции:

Значение стандартной энтальпии образования сложного вещества зависит от природы вещества и его агрегатного состояния. Числовые значения стандартных энтальпий образования веществ приводятся в справочниках.
Энтальпию реакции можно определить как экспериментально, так и методом расчета с использованием стандартных энтальпий образования веществ, участвующих в химической реакции, на основе закона, открытого академиком Российской академии наук Г. И. Гессом (1840).
 |
Энтальпия реакции, т. е. тепловой эффект реакции, зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которому протекает реакция.
Закон Гесса можно проиллюстрировать следующей схемой:
Переход из начального состояния системы в конечное состояние можно осуществить разными путями:
- непосредственно через реакцию, энтальпия которой равна  Нр;
Нр;
- в результате двухстадийного процесса через промежуточное состояние А, энтальпии отдельных стадий которого равны соответственно  Н1 и
Н1 и  Н2;
Н2;
- через ряд реакций трехстадийного процесса через промежуточные состояния В и С, для которых энтальпии отдельных стадий равны соответственно  Н3,
Н3,  Н4 и
Н4 и  Н5,.
Н5,.
В соответствии с законом Гесса:

В термохимических расчетах большое значение имеют следствия из закона Гесса.
Дата публикования: 2014-10-16; Прочитано: 2125 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
