 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторная работа. Сера, соединения серы и селена
|
|
Все опыты с элементарной серой, ее соединениями и соединениями селена следует проводить в вытяжном шкафу.
Аллотропические видоизменения серы
1. Ромбическая сера. Кусочек черенковой серы величиной с горошину поместить в сухую пробирку и прилить около 2 мл хлороформа. Пробирку встряхивать до тех пор, пока значительная часть серы не перейдет в раствор. Полученный раствор слить на часовое стекло, дать растворителю испариться. При помощи микроскопа рассмотреть полученные на стекле кристаллы, зарисовать их в журнале.
2. Пластическая сера. Наполнить микропробирку наполовину кусочками серы и, держа ее при помощи зажима, медленно нагревать на пламени горелки до плавления, все время встряхивая пробирку. Наклонить слегка пробирку, наблюдать, как подвижная янтарная жидкость течет по стенке пробирки. При дальнейшем нагревании наблюдать изменение цвета жидкости и увеличение ее вязкости (из опрокинутой кверху дном пробирки жидкость при температуре ~ 200°С не выливается). При нагревании вплоть до температуры кипения сера темнеет и вновь становится подвижной. Кипящую серу вылить тонкой струей в кристаллизатор с холодной водой. При выливании расплавленной серы в холодную воду происходит как бы "замораживание" равновесия между осколками молекул ромбической серы (S6, S4 и др.). Выделенная из воды твердая сера пластична, тянется, имеет волокнистую структуру. Волокна серы состоят из свернутых в спираль цепей атомов серы, состав этой модификации выражается формулой Sx. Полученную массу вынуть из воды и высушить между листами фильтровальной бумаги. Испытать пластичность серы и ее растворимость в сероуглероде.
Свойства серы
Сера может проявлять как окислительные, так и восстановительные свойства в реакциях с простыми и сложными веществами, а также вступать в реакции диспропорционирования.
3. Окисление меди парами серы. Поместить кусочек серы величиной с горошину в пробирку, закрепить пробирку в зажиме штатива и нагреть серу до кипения. Когда пары кипящей серы заполнят всю пробирку доверху, внести в нее пинцетом, не убирая горелки, кусочек тонкой медной проволочки. Отметить энергичную реакцию горения меди в парах серы. Записать наблюдаемое, уравнение реакции и указать окислитель и восстановитель.
4. Окисление серы азотной кислотой. В пробирку внести небольшой кусочек серы и 5-6 капель концентрированной азотной кислоты (плотность 1,4 г/см3). Осторожно нагреть пробирку. Отметить выделение газа. Полученный раствор (2-3 капли) перенести пипеткой а пробирку с раствором хлорида бария (5-6 капель). Отметить появление осадка и его цвет. На существо-вание какого иона в растворе указывает образование осадка? Написать уравнение реакции взаимодействия серы с азотной кислотой, указать окислитель и восстановитель.
5. Реакция диспропорционирования серы в щелочном растворе. В маленький тигель поместить порошок серы, прилить концентрированный раствор щелочи. Смесь осторожно нагреть и кипятить10 мин. На смоченный раствором ацетата свинца кусочек бумаги нанести 1-2 капли полученного раствора. Что наблюдается? Какой ион присутствует в растворе? В оставшийся раствор прилить несколько капель раствора нитрата стронция для обнаружения в растворе сульфит-ионов. Написать уравнения проведенных реакций. Указать роль серы в реакции со щелочью.
Получение сероводорода и изучение его свойств
Сероводород содержит серу в состоянии окисления - 2 и проявляет поэтому только восстановительные свойства. Сероводород является очень токсичным веществом, предельно допустимая концентрация около 5 · 10-4 %(об.). Все опыты с ним следует проводить в вытяжном шкафу.
6. Получение и горение сероводорода. В пробирку, на 1/3 наполненную
полненную кусочками сернистого железа, внести 5-6 капель кусочками сернистого железа, внести 5-6 капель соляной кислоты (плотность 1,19 г/см3). Закрыть пробирку пробкой с отводной изогнутой кверху трубкой и закрепить ее в штативе (ррис.14).
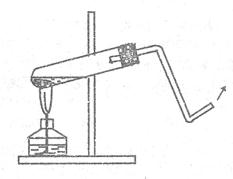 Выделяющийся газ зажечь у конца отвод
Выделяющийся газ зажечь у конца отвод
ной трубки. Над пламенем горящего газа подержать смоченную дистиллированной
водой синюю лакмусовую бумажку.
Отметить изменение ее цвета и сделать вы вод о продукте сгорания сероводорода.
В пламя горящего газа внести чистую фарфоровую пластинку. Объяснить появление на ней желтого налета серы.
Рис.14. Прибор для получения
сероводорода
Написать уравнения реакций получения сероводорода, полного и неполного его сгорания, взаимодействия газа, полученного при полном сгорании сероводорода, с водой. Указать, какие из этих реакций относятся к окислительно-восстановительным.
7. Определение среды в водном растворе сероводорода. В пробирку с сернистым железом добавить 2−3 капли концентрированной соляной кислоты (плотность 1,19 г/см3). Закрыть пробирку пробкой с отводной изогнутой книзу трубкой (рис. 9). Выделяющийся сероводород направить в коническую пробирку, на 1/з наполненную дистиллированной водой. Несколько капель сероводородной воды внести в пробирку с раствором лакмуса. Отметить и объяснить изменение цвета лакмуса. Написать уравнение диссоциации сероводородной кислоты и выражение ступенчатых констант ее диссоциации. Указать силу этого электролита. Оставшуюся сероводородную воду использовать в последующих опытах.
8. Восстановление сероводородом марганца(VII), хрома(VI) и железа (III). В три пробирки внести следующие растворы: в первую – 5 капель перманганата калия и 2 капли 1 моль/л раствора серной кислоты; во вторую - 5 капель бихромата калия и 2 капли 1 моль/л раствора H2SО4; в третью – 5 капель хлорида железа(III). В каждую из пробирок добавить по каплям сероводородной воды до изменения окраски растворов и их помутнения вследствие выделения серы. Написать соответствующие уравнения реакций, учитывая, что марганец(VII) и железо(III) переходят в двухвалентное состояние, а хром(VI) - в трехвалентное.
Получение сульфидов металлов и их свойства
Сульфиды металлов могут быть получены не только прямым синтезом, но также из водных растворов. Способность сульфидов выделяться в осадок, растворяться в минеральных кислотах определяется величиной их произве-дения растворимости. Осаждение плохо растворимых сульфидов (HgS, CuS, CdS, РbS, Sb2S3, SnS и др.) мoжно вести сероводородом из кислых сред (рН ≈ 0,5; Сн+ = 0,3 моль/л). Для осаждения более растворимых сульфидов (ZnS, MnS, FeS) необходим более высокий рН, и поэтому используют аммиачный раствор свежеприготовленного (NH)2S, в котором концентрация ионов S2– значительно выше, чем в сероводородной воде. В результате произведение концентраций ионов Zn2+, Mn2+, Fe2+ и сульфид-иона получается больше произведений растворимости, и сульфиды этих металлов в указанных условиях выпадают в осадок.
9. Получение бисульфида и сульфида натрия в растворе. Внести в пробирку 5 капель 6 моль/л раствора гидроксида натрия и пропустить через него медленный ток сероводорода до полного насыщения (3-5 мин). К полученному раствору бисульфида натрия прибавить еще 5 капель такой же щелочи для получения сульфида натрия. Для доказательства наличия в растворе сульфид-иона несколько капель полученного раствора перенести в другую пробирку и прилить 5-6 капель раствора соли марганца(II). Оставшийся раствор сульфида натрия сохранить для последующих опытов. Написать уравнения проделанных реакций.
10. Получение сульфидов кадмия, марганца(II), железа(III) и свинца(II). Отношение их к сильной кислоте. В четыре пробирки внести по 3–5 капель растворов солей кадмия, марганца(II), железа(II), и свинца(II),) соответственно. В каждый раствор добавить по 2–3 капли полученного раствора сернистого натрия (или аммония). Отметить появление осадков, указать их цвета. После отстаивания растворов пипеткой удалить маточник, и к осадкам прибавить по 3–5 капель 2 моль/л раствора азотной кислоты. Пользуясь величинами произведения растворимости, объяснить, почему сульфиды данных металлов различно взаимодействуют с азотной кислотой. В молекулярной и ионной формах написать уравнения реакций образования и растворения сульфидов.
Получение полисульфидов, их разложение
Сера способна растворяться в концентрированных растворах сульфидов щелочных, щелочноземельных металлов и аммония, образуя полисульфиды:
ֵֵֵ
 S + S׃ → S
S + S׃ → S
Na ¨ Na ¨ Na ¨ ¨¨ Na
S
¨ 
сульфид дисульфид
11. Получение полисульфида натрия и полисульфана. Небольшое количество серы смочить этиловым спиртом и в закрытом сосуде встряхивать с 10%-ным раствором Na2S продолжительное время. Непрореагировавшую се-ру отфильтровать, к фильтрату добавить по каплям 2 моль/л раствор HCI до кислой реакции. Объяснить появление коллоидного осадка. Написать уравнения реакций получения полисульфида натрия Na2Sn и полисульфана H2Sn. Сравните кислотные свойства пар: Н2O и Н2O2; H2S и H2S2. Дайте пояснения.
Получение сернистого ангидрида и сернистой кислоты,
изучение их свойств и свойств сульфитов
В сернистом ангидриде, сернистой кислоте и ее солях сера находится в промежуточной степени окисления (+4), поэтому эти соединения могут проявлять как восстановительные, так и окислительные свойства, вступать в реакции диспропорционирования. Сульфит натрия способен также к реакциям присоединения, например:
 Na –O NaO S
Na –O NaO S
S = O + S ׃ → S
Na –O ¨ NaO O
12. Получение сернистого газа, растворение его в воде. В пробирку поместить 0,2 г сульфита натрия, добавить 3–5 мл 2 моль/л раствора серной кислоты и быстро закрыть пробкой с отводной трубкой. Выделяющийся газ пропустить через находящуюся в пробирке дистиллированную воду (5 мл). Если выделение газа идет недостаточно энергично, пробирку подогреть слабым пламенем горелки. Несколько капель полученного раствора внести в пробирку с раствором нейтрального лакмуса. Объяснить изменение цвета лакмуса, оставшийся раствор сернистого газа использовать для последующих опытов. Изобразить схему равновесий в водном растворе сернистого газа. Существуют ли в растворе молекулы H2SО3?
13. Восстановительные свойства сернистого газа. К 5–8 каплям полученного в предыдущем опыте водного раствора сернистого газа прилить несколько капель бромной воды, наблюдая ее обесцвечивание. Используя значения стандартных потенциалов полуреакций восстановления:

 ,
,
Указать окислитель и восстановитель в реакции.
К 2–3 каплям сильно разбавленного водой фуксина добавить по каплям раствор сернистой кислоты до обесцвечивания раствора. На чем основано белящее действие сернистой кислоты?
14. Восстановительные свойства сульфит-аниона в кислой среде. В три пробирки поместить по 5–8 капель 0,5 моль/л раствора Na2SO3, подкислить его 2-3 каплями 5 моль/л раствора уксусной кислоты, провести реакции с несколькими каплями растворов Н2О2 (– 2,5 моль/л), КМnО4 (0,02 моль/л), К2Сг2O7 (0,2 моль/л) соответственно. Объяснить наблюдаемое, уравнения реакций уравнять методом полуреакций.
15. Окислительные свойства сульфит-аниона в кислой среде. Несколько кристалликов Na2SО3 растворить в пробирке с водой, подкислить 1–2 каплями 2 моль/л раствора H2SО4 и быстро внести в смесь несколько капель сероводородной воды. Что наблюдается? Указать свойство, проявляемое сульфит-анионом в этой реакции

16. Диспропорционирование сульфита калия при нагревании. В тугоплавкую пробирку поместить 0,1–0,2 г безводной соли K2SО3, нагреть пламенем горелки до образования темноокрашенного расплава. После охлаждения содержимое пробирки растворить в минимальном количестве воды. Раствор обработать соляной кислотой (отметить запах H2S и почернение влажной бумаги, смоченной раствором Pb(NО3)2), нагреть до полного удаления H2S, отфильтровать, в фильтрате осадить сульфат-ион раствором хлорида бария. Как диспропорционирует cepa (IV) при нагревании K2SО3?
17.Получение тиосульфата натрия. Насыпать в фарфоровую чашку ~ 0,1 г порошка серы, смоченного спиртом, прилить 3–4 мл концентрированного раствора Na2SО3, нагреть на слабом огне, помешивая стеклянной палочкой, до растворения большей части серы. Нерастворившуюся серу отфильтровать. Изучить взаимодействие полученного раствора с раствором иода, соляной кислоты. Написать уравнения реакций.
Серная кислота и ее свойства. Соли серной кислоты
Серная кислота проявляет свои окислительные свойства в разбавленных растворах за счет протона:
2Н+ + 2 еˉ = Н2
В концентрированной серной кислоте окислителями являются молекулы кислоты:
2H2SО4 + 2еˉ= SО42− + SО2 + 2Н2О
За счет низкой упругости водяных паров над раствором концен концентрированной серной кислоты по сравнению с упругостью паров атмосферы она обладает сильным водоотнимающим свойством. От органических соединений концентрированная H2SО4 отнимает элементы воды, обугливая большинство углеводов. В растворах присутствие иона SО42− обнаруживают с помощью образования белых осадков плохорастворимых сульфатов бария BaSО4 с ПР = 1,08·10−10, свинца PbSО4 с ПР = 2,2·10−8, где ПР - произведение растворимости.
18. Взаимодействие металлов с разбавленной серной кислотой. В три пробирки внести по 5–8 капель 1 моль/л раствора серной кислоты и по 2–3 кусочка металлов: в первую – цинка, во вторую – железа, в третью – меди. Если реакция идет медленно, то слегка подогреть пробирки небольшим пламенем горелки. Описать наблюдаемое. Объяснить, почему реакция идет не во всех случаях.
19. Взаимодействие меди с концентрированной серной кислотой. В тигель поместить 1–2 кусочка медной стружки и прилить 5–10 капель конц. H2SО4. Тигель нагреть на асбестовой сетке небольшим пламенем горелки. Поднести влажную синюю лакмусовую бумажку к отверстию тигля. Отметить изменение ее окраски. По запаху (осторожно!) определить, какой газ выделяется. Объяснить, в чем различие действия концентрированной и разбавленной серной кислоты на металлы. Чем объясняется большая сила и устойчивость серной кислоты по сравнению с сернистой кислотой?
20. Взаимодействие неметаллов с концентрированной H2SО4. В две пробирки налить по 1–2 мл конц. H2SО4, внести в одну из них небольшой кусочек серы, в другую угля, пробирки осторожно нагреть (тяга!). Что наблюдается?
21. Вытеснение серной кислотой слабой кислоты из раствора ее соли. В пробирку с насыщенным раствором молибдата аммония (NH4)2MoО4 (3–4 капли) прилить осторожно по каплям конц. H2SО4 до выпадения осадка молибденовой кислоты. Осадок отцентрифугировать или дать ему отстояться и прилить к осадку конц. H2SО4 до его растворения с образованием сульфата диоксимолибденила(VI) MoO2SO4.
22. Взаимодействие серной кислоты с целлюлозой бумаги. На листочке фильтровальной бумаги с помощью стеклянной палочки сделать надпись раствором серной кислоты (1:1). Бумагу просушить, держа высоко над пламенем горелки. Объяснить почернение бумаги, написать уравнение реакции. Какое свойство проявляет здесь серная кислота?
23. Получение труднорастворимых сульфатов. На три часовых или предметных стекла поместить по 1 капле 1 моль/л раствора серной кислоты и добавить по 1 капле растворов солей бария, свинца и стронция. Отметить цвета образовавшихся осадков, сравнить значения их ПР.
Свойства тиосульфата натрия
Тиосерную кислоту можно рассматривать как производную серной кислоты, в которой атом кислорода замещен на атом серы:
OH
׀
HO – S+6 = S−2!
׀׀
O
Тиосерная кислота – нестабильное вещество, за счет внутримолекулярного окислительно-восстановительного процесса распадается с образованием серы, сернистого газа и воды. Скорость распада кислоты зависит от концентраций ее соли и сильной кислоты. Тиосульфат натрия проявляет восстановительные свойства, которые можно объяснить присутствием в нем атома серы со степенью окисления –2.
24. Взаимодействие тиосульфата натрия с серной кислотой. Внести в пробирку 5-6 капель раствора тиосульфата натрия Na2S2О3 и 3−4 капли 1моль/ л раствора серной кислоты. Что наблюдается? Написать уравнение реакции взаимодействия Na2S2O3 с H2SO4 по ступеням и в общем виде.
25. Взаимодействие тиосульфата натрия с хлорной водой. К раствору тиосульфата натрия (5−6 капель) приливать по каплям хлорную воду до появления осадка свободной серы. Отфильтровать серу, к раствору прибавить несколько капель раствора BaCl2. Что наблюдается? Написать уравнение реакции окисления тиосульфата натрия хлором в присутствии воды.
26. Взаимодействие тиосульфата натрия с йодной водой. В пробирку с йодной водой (5-6 капель) прибавить по каплям раствор тиосульфата натрия до обесцвечивания йодной воды. Проверить действие BaCl2 на полученный раствор. Написать в молекулярной форме уравнение этой окислительно-восстановительной реакции, учитывая, что в результате ее образуется тетратионат натрия Na2S4O6:
I2 + 2е− = 2I−,
2S2O32− – 2 е − = S4O62−.
Свойства персульфатов
Соли надсерной кислоты (персульфаты) обладают окислительными свойствами за счет пероксогруппы пероксодисерной кислоты
O O
 ׀׀ O ׀׀
׀׀ O ׀׀
HO – S S – OH!
׀׀ O ׀׀
O O
27.Окисление иодид-иона персульфатом аммония. В пробирку с раствором иодида калия (3–4 капли), подкисленного серной кислотой, прибавить 3–4 капли раствора персульфата аммония (NH4)2S2O8. Наблюдать медленное из-менение окраски раствора. В раствор внести 1–2 капли раствора крахмала. Написать уравнение реакции, методом полуреакций подобрать коэффициенты.
28. Окисление хрома(III) персульфатом аммония. Пробирку с растворами соли хрома(III) (3–4 капли), серной кислоты (2–3 капли) и нитрата серебра (1–2 капли) нагреть на малом пламени горелки. В горячий раствор внести 2–3 кристаллика персульфата калия или аммония и снова нагреть смесь до изменения окраски. Что наблюдается? Уравнение реакции уравнять методом полуреакций.
Свойства селенистой кислоты и селенитов
Соединения селена и теллура очень ядовиты!
Восстановительные свойства селенитов и теллуритов по сравнению с сульфитами выражены слабо, а окислительные – гораздо сильнее, причем окислительное действие зависит от рН.
29. Восстановление перманганата калия селенистой кислотой. В пробирку налить 3 каппи раствора КМnО4, две капли 1 моль/л раствора H2SО4, затем добавить 5–6 капель раствора H2SeО3, раствор перемешать. Записать наблюдения и уравнение реакции. Какие свойства проявила селенистая кислота в данной реакции?
30. Восстановление селенистой кислоты цинком. В пробирку с подкисленным раствором селенистой кислоты (3–4 капли) внести очищенный от пленки оксида кусочек цинка. Через некоторое отметить выделение на цинке свободного красного селена. Чем выступает H2SeО3 в этой реакции?
31. Восстановление селенистой кислоты сернистым газом. К концентрированному раствору H2SeО3 или раствору селенита, подкисленному соляной кислотой, прилить насыщенный раствор сульфита натрия и осторожно нагреть. Объяснить выделение красно-коричневого аморфного осадка.
5.3.5.Дополнительный опыт
Определение температуры плавления тиосульфата натрия Na2S2О3·5H2О. В стакан с водой (водяная баня), находящийся на электрической плитке, поместить широкую пробирку, заполненную на 1/з тиосульфатом натрия, пробирку закрепить в штативе. В соль опустить термометр. Включив нагрев, секундомер, записывать показания термометра через каждые 30 с до полного перехода твердой фазы в жидкую. Построив зависимость температура время, объяснить ход кривой, определить температуру плавления Na2S2О3·5H2О, сравнить полученное значение с литературным.
Для определения температуры плавления (< 100 °С) можно собрать простой прибор по рис. 15.
 Стеклянный капилляр 1 заполнить мелкими кристаллами исследуемого вещества, закрепить капилляр у ртути термометра 2 резиновым кольцом. Опустить термометр с капилляром в пробирку-воздушник 3, опущенную в стакан с водой 4. Медленно нагревать воду в стакане и наблюдать за плавлением соли (можно воспользоваться для наблюдения лупой). В момент расплавления соли (появления мениска) отметить температуру. Опыт повторить 2 раза и найти среднюю величину температуры плавления.
Стеклянный капилляр 1 заполнить мелкими кристаллами исследуемого вещества, закрепить капилляр у ртути термометра 2 резиновым кольцом. Опустить термометр с капилляром в пробирку-воздушник 3, опущенную в стакан с водой 4. Медленно нагревать воду в стакане и наблюдать за плавлением соли (можно воспользоваться для наблюдения лупой). В момент расплавления соли (появления мениска) отметить температуру. Опыт повторить 2 раза и найти среднюю величину температуры плавления.
Рис.15. Прибор для определения
для температуры плавления веществ
5.3.6. Синтезы соединений серы
1. Синтез тиосульфата натрия. В микроколбу, снабженную обратным холодильником (рис.16), поместить 2,5г мелкоизмельченной черенковой серы, смочить ее этиловым спиртом, а затем добавить раствор 3,5 г Na2SО3 в 50 мл воды. После предварительной обработки спиртом сера хорошо смачивается раствором и не всплывает на его поверхность.
 Смесь кипятить до тех пор, пока проба раствора не покажет нейтральную или слабощелочную реакцию. Горячий раствор отфильтровать от избытка серы и упарить на водяной бане до начала кристаллизации. Смесь охладить, образовавшиеся кристаллы Na2S03·5Н2О отсосать на воронке Бюхнера и вы высушить при комнатной температуре.
Смесь кипятить до тех пор, пока проба раствора не покажет нейтральную или слабощелочную реакцию. Горячий раствор отфильтровать от избытка серы и упарить на водяной бане до начала кристаллизации. Смесь охладить, образовавшиеся кристаллы Na2S03·5Н2О отсосать на воронке Бюхнера и вы высушить при комнатной температуре.
Рис. 16. Прибор для получения
тиосульфата натрия
Взвесить полученную соль и определить процент выхода. Тиосульфат натрия образует прозрачные моноклинные кристаллы, легко растворимые в воде. При температуре выше 48,5°С они начинают плавиться в кристаллизационной воде, а при 100°С – обезвоживаются. Провести качественный анализ на обнаружение тиосульфат-ионов, используя раствор иода и крахмала, а также разбавленные растворы серной или соляной кислот. Определить температуру плавления полученных кристаллов.
2. Синтез нитрозилгидросульфата. В колбу, помещенную в охлаждающую смесь, налить 10 мл азотной кислоты (р = 1,60 г/см3) и после ее охлаждения по трубке, опущенной в кислоту, пропустить ток очищенного оксида cepы(IV). Температура в колбе не должна подниматься выше 5°С. Реакция взаимодействия SО2 с азотной кислотой идет по уравнению
SО2 + HNО3 = (NО)HSО4
После того, как выделится бесцветная кристаллическая масса, ее необходимо отсосать через стеклянный фильтр и промыть ледяной уксусной кислотой, четыреххлористым углеродом, затем высушить в фарфоровой чашке в эксикаторе над оксидом фосфора(V). Нитрозилгидросульфат под действием влаги воздуха подвергается гидролизу, поэтому вещество следует хранить в запаянной ампуле.
Нитрозилгидросульфат плавится с разложением при 73,5°С. В отчете по синтезу изобразите структурную формулу (NО)HSО4.
Нитрозилгидросульфат может быть также получен по реакции взаимодействия N2O3 с H2SO4.
3. Синтез сульфида алюминия. Предварительно термодинамическим расчетом обосновать необходимость проведения синтеза Al2S3 в твердой фазе, а не в растворе. Для этого необходимо, пользуясь данными приложения 1, рассчитать изменение энергии Гиббса Δ G °298 реакций взаимодействия ионов Al3+ (р) и S2– (p) в водном растворе с образованием соответственно Al2S3(т) и А1(ОН)3(т):
2А13+(р) + 3S2–(p) = A12S3(т),
2A13+(p) + 6OНˉ(р) = 2А1(ОН)3(т)
Показать, какой из указанных процессов наиболее термодинамически вероятен при стандартных условиях. Дать объяснение полученному факту, исходя из реакций взаимодействия ионов А13+ и S2– с водой, являющейся амфолитом. Далее оценить возможность самопроизвольного протекания реакции
2А1(т) + 3S(т, ромб.) = A12S3(t)
при 298 К. При каких допущениях можно использовать полученные данные для оценки возможности протекания реакции при более высоких температурах?
Получение сульфида алюминия необходимо проводить осторожно, в очках и перчатках, в вытяжном шкафу. Смесь 1 в.ч. крупнозернистого порошка алюминия и 2 в.ч. "серного цвета" поместить в объемный тигель, смесь зажечь с помощью магниевой ленты, при бурном протекании реакции тигель закрыть крышкой, подождать окончания реакции. Еще расплавленную массу вылить на железный лист, охладить, раздробить на кусочки, внести в плотно закрывающуюся склянку. Полученный таким образом сульфид содержит примесь алюминия и серы. Продукт синтеза представляет собой желто-серую массу с запахом сероводорода, tпл= 1100 °С. Два микрошпателя Al2S3 внести в сухую пробирку, прилить 5 мл горячей воды, убедиться в образовании H2S и Al(OH)3.
4. Получение сжиженного сернистого газа. В вытяжном шкафу собрать прибор (рис.17), состоящий из колбы Вюрца 1, капельной воронки 2, склянки Тищенко 3 с концентрированной серной кислотой, сухой пробирки 4, опущенной в стакан 5 с охладительной смесью, и склянки Тищенко 6с дистиллированной водой. В колбу 1 насыпать сульфита натрия, а в капельную воронку 2 налить концентрированной серной кислоты. Стакан 5 заполнить охладительной смесью, состоящей из 2 частей льда и 1 части поваренной соли (следить, чтобы смесь не попала в пробирку 4). Температура охладительной смеси должна быть на 5–6 °С ниже температуры сжижения сернистого газа (чему она равна?). Пробирку 4 плотно закрыть пробкой с двумя газоотводными трубками (как показано на рис.17), соединенными со склянками Тищенко 3 и 6.

Рис. 17. Прибор для сжижения сернистого газа
Осторожно открывая кран капельной воронки, по каплям приливать кислоту к сульфиту. Наблюдать сжижение сернистого газа в пробирке 4. После того, как вся кислота и сульфит прореагируют, закрыть кран у капельной воронки, осторожно отсоединить склянки Тищенко 3 и 6. Тотчас же проделать с полученным жидким сернистым газом следующие опыты. Взяв пробирку специальным держателем, снять с нее пробку и часть жидкого сернистого газа перелить в стакан с небольшим количеством воды (вода должна лишь покрывать дно стаканчика). Что получается в стаканчике? В оставшийся в пробирке жидкий сернистый газ осторожно опустить несколько стружек магния. Для сравнения бросить кусочек магния в водный раствор сернистого газа, полученный в стаканчике. Объяснить наблюдаемое, записать уравнения реакций.
5.3.7. Задания для самостоятельной работы
21. Приведены длины связей О–О в различных соединениях кислорода:
 O2
O2  O22−
O22−
d, Å 1,123 1,207 1,30 1,49
Укажите, какой заряд (положительный или отрицательный) имеет группа О2 в соединениях КО2, BaО2, О2[PtF6], [V(О2)4 ]3-, если длины связей О–О в них равны соответственно 1,28; 1,49; 1,17; 1,40 Å.
22. В рамках модели локализованных атомных орбиталей дайте описа-ние электронного строения иона гидроксония Н3О+ (показать перекрывание атомных орбиталей, тип гибридизации центрального атома и форму иона).
23. Объясните причину того, что дипольный момент молекулы Н2О (1,85 D) намного больше, чем у молекулы F2О (0,297 D), хотя валентные углы в обеих молекулах близки.
24. Изобразите структурные формулы следующих молекул: Cl2O7, OF2, O2F2, ClO3F, NO3F.
25. Назовите нейтральную молекулу, изoэлектронную молекулярному иону O22−. Объясните факт возрастания длины связи в ряду
 < O2 < O2− < O22−
< O2 < O2− < O22−
26. Как повлияет на выход хлора в системе
4НСl(г) + O2 ⇆ 2Cl2(г) + 2H2O(ж), Δ Н °298 = -202,4 кДж.
а) повышение температуры в реакционном объеме; б) уменьшение общего объема смеси; в) уменьшение концентрации кислорода; г) увеличение объема реактора; д) введение катализатора?
27. Опишите строение газообразных молекул и укажите вероятный тип гибридизации центрального атома: диоксид серы, триоксид серы, хлористый тионил, хлористый сульфурил, четыреххлористый теллур.
28. Углы между связями в газообразных молекулах гидридов VI группы равны: Н2О − 105o; H2S − 92o; H2Se − 91o; Н2Те − 89,5o. Объясните величины углов между связями и причины их изменения при переходе вниз по подгруппе.
29. Методами микроволновой спектроскопии установлена длина связи в молекуле SO2 1,432 Å, угол между связями равен равен 119,5o, а электрический дипольный момент молекулы 1,589 D. Вычислить электрические заряды на атомах (предположить, что они сосредоточены на ядрах атомах).
30. Чему равна степень диссоциации H2S по первой ступени (К 1 = 1,0·10−7), [Н+] и рН в насыщенном растворе сероводорода (0,1 моль/л H2S)?
31. Соль PbSО4 значительно менее растворима в воде, чем Pb(HSО4)2. Объясните этот факт.
32. Раствор серной кислоты объемом 100 мл был приготовлен из 10,66г H2SО4 и 95,94г Н2О. Вычислить молярную, нормальную концентрации раствора и его моляльность. Реакция полученного раствора H2SО4 с раствором NaOH протекает по уравнению
H2SО4 + 2NaOH = Na2SО4 + 2Н2О
33. С чем связана способность серы растворяться в концентрированных растворах сульфидов щелочных и щелочноземельных металлов?
34. Используя данные по электродным потенциалам, укажите, в каком направлении пойдут реакции при сливании раствора Na2SО3 с бромной водой, с сероводородной водой.
35. Используя значения электродных потенциалов, покажите, будут ли протекать реакции при приливании сероводородной воды к раствору концентрированной азотной кислоты, к кислому раствору КМпО4, к хлорной воде. Написать уравнения реакций.
36. Составьте таблицу, иллюстрирующую зависимость типа оксида от положения элемента в периодической системе и его степени окисления.
37. Исходя из электронного строения атомов, обоснуйте возможность pn-dπ-связывания в SО2 и ТеО2.
38. Водяной пар разлагается при высокой температуре по уравнению
Н2О(г) = Н2(г) + 1/2О2(г)
Оцените температуру, при которой константа равновесия указанной реакции К = 1.
39. Для реакций получения NaAIО2(т), Na2SiО3(т), Na3PО4(т) из оксидов вычислите Δ G o в расчете на 1 моль Na2О и сделайте заключение о характере изменения кислотно-основных свойств оксидов в ряду алюминий–кремний– фосфор.
40. В природном кислороде атомное отношение изотопов
16О: 17О: 18О = 3500: 1: 5.
Какова атомная масса природного кислорода?
ТЕМА 6. ЭЛЕМЕНТЫ ГЛАВНОЙ ПОДГРУППЫ ПЯТОЙ ГРУППЫ
6.1. Общая характеристика главной подгруппы
У элементов главной подгруппы пятой группы (N, Р, As, Sb, Bi) пять валентных электронов находятся в состоянии ns2np3, где п принимает значения от 2 до 6. В подгруппе при переходе сверху вниз увеличивается радиус атома, ковалентность, координационное число, например по кислороду (NО−, РO43−, AsO43−, Sb(OH)6−); уменьшается энергия ионизации, электроотрицательность, способность атомов к образованию π-связей и к проявлению высшей степени окисления: фосфор чаще всего имеет степень окисления +5, мышьяк +5 или +3, для сурьмы характерна степень окисления +3 (редко +4) и для висмута чаще всего +3. Соединения пятивалентного висмута являются сильными окислителями.
В силу выше указанного изменения свойств атомов элементов в главной подгруппе пятой группы при переходе сверху вниз ослабевают неметаллические свойства элементов:
- азот, фосфор - типичные неметаллы, с островными молекулами N2, Р4, образующими молекулярную решетку образует почти металлические кристаллы с к.ч.= 6;
- уменьшается термодинамическая стабильность соединений с водородом ЭН3, а соединений Э2O3, ЭС13 - увеличивается;
- равновесие
Э3+ + ЗН2O ⇆ ЭО33− + 6Н+
в кислой среде сдвинуто влево для висмута и сурьмы (в BiF3, Bi(NО3)3·5H2О, Sb2(SО4)3 эти элементы образуют катионы; в слабокислых растворах SbCl3 и ВiC13 гидролизуются с образованием ЭОС1); для азота(III) и фосфора(Ш) указанное равновесие сдвинуто вправо в силу их неметаллического характе-ра;
- оксиды и гидроксиды трехвалентных элементов изменяют свой характер от кислотного (N2О3, HNО2) до основного (Bi2О3, Bi(OH)3).
6.2. Азот
6.2.1. Теоретическая часть
Структура внешнего электронного слоя атома азота имеет вид


 ↑ ↑ ↑ 2p
↑ ↑ ↑ 2p
 ⇅ 2s
⇅ 2s
Четыре валентные орбитали атома азота могут находиться в состоянии sp-, sp2-, 5р3-гибридизации; координационное число азота может принимать значения 2, 3, 4. Не исключается, что у атома азота за счет промотирования 2 s -электрона в третий слой (n = 3) может образоваться пять неспаренных электронов и, соответственно, пять ковалентных связей (осуществлен синтез NOF3). Этот процесс промотирования требует меньшей затраты энергии (1570 кДж/моль), чем образование иона азота(IV) (̴ 1970 кДж/моль).
В отличие от других элементов (Р, As, Sb, Bi) азот легко образует кратные связи. Если другие элементы главной подгруппы пятой группы образуют молекулы Р4, As4, Sb4 с σ-связями, то для азота характерна двухатомная молекула:N≡N: - с σ- и π-связями, с малым межъядерным расстоянием (1,094 А) и высокой прочностью связи (946 кДж/моль). Кратные связи образует азот с углеродом (-C≡N), кислородом: N = O: (неспаренный электрон расположен на разрыхляющей орбитали).
Молекула азота N2 может выступать в качестве π-донорного лиганда, образуя при нормальных условиях комплексы, например состава [Ru(NH3)5N2]X2.
Для азота (в отличие от углерода) не характерно образование гомоцепей, так как связь N-N является слабой.
Основным водородным соединением азота является аммиак, водный раствор которого может быть описан формулой NH3· aq и равновесием
NH3 + Н2О ⇆ NH4+ + ОН+, К = [NH4+] [OH-] / [NH3] = 1,8·10−5.
Соли иона аммония и сильных кислот в водном растворе имеют слабо-кислую реакцию
NH4+ + H2О ⇆ NH3 + H3О+.
Так, в 1 моль/л растворе NH4Cl pH ̴ 4,7.
Кроме основных, восстановительных свойств аммиак за счет неподеленной пары азота проявляет донорные свойства к таким акцепторам, как протон, катионы d-металлов:
:NH3 + H+ ⇆ [NH4]+
4:NH3 + Cu2+ ⇆ [Cu(NH3)4]2+.
Известно большое количество соединений, которые можно рассматривать как производные аммиака, получающиеся замещением атомов водорода органическими или неорганическими радикалами. Так, гидразин


 H H
H H





 N–N
N–N
H H
 и гидроксиламин
и гидроксиламин
 H
H


 N–O–H
N–O–H
H
можно рассматривать как продукты замещения атомов водорода в NH3 на изоэлектронные группы -NH2 и -ОН соответственно. Основные свойства у этих соединений выражены слабее, чем у аммиака:
N2H4 + Н2О ⇆ N2H5+ + ОН−, К1= 8,5-10 −7;
N2H5+ + Н2О ⇆ N2H62+ + ОН−, К2 = 8,9-10 −15;
NH2OH + Н2О ⇆ NH3OH+ + ОН+, К1 = 6,6-10–9.
Гидразину, гидроксиламину, как и аммиаку, присущи восстановительные свойства.
Во многих отношениях схожи между собой жидкие аммиак и вода, например, схожи их реакции самоионизации:
2NH3 ⇆ NH4+ + NH2-, К = [NH4+][NH2-] ≈ 10−30 (–50оС);
2H2O ⇆ H3O + OH-, K = [H3O+][OH-] = 10−14 (25оC);
реакции взаимодействия с электроположительными металлами; схожи также производные аммиака и воды: NH4+Cl и Н3O+Сl− имеют кислотный характер; Na+OH-, Na+NH2-, Mg2+O2−, Mg32+ N3−2, Li+2NH2−, Li+2O2− – основной. Амид-, имид- и нитрид-ионы существуют в виде свободных ионов только в солях наиболее электроположительных металлов.
Хотя азотистоводородная кислота HN3 формально и является водородным соединением азота, но связь ее с NH3, N2H4 отсутствует, она проявляет свойства слабой кислоты (К д = 1,8·10-5).
Азот, образуя соединения с ковалентным типом связи, проявляет при этом все возможные формальные степени окисления от –3 до +5 NH3(–3), N2H4(–2), NH2OH(–1), N2(O), N20(+1), NO(+2), HNO2(+3), NO2(+4), N2Os(+5). Положительные степени окисления азот проявляет в соединениях с фтором и кислородом.
Кислородные соединения азота представлены оксидами, кислородосодержащими кислотами и их солями.
Газообразная закись азота
+ _
:О = N = N:
¨ ¨
при комнатной температуре сравнительно нереакционноспособна. Молекулы NО и МО2 содержат по неспаренному электрону, но моноокись не ассоции-рована и бесцветна, a NO2 обнаруживает характерную для парамагнитных молекул ассоциацию, зависящую от температуры:

 N2O4 + 61,5 кДж
N2O4 + 61,5 кДж
бурый, бесцветный,
парамагнитный диамагнитный
В твердом состоянии существуют только молекулы N2О4, имеющие плоское строение


 О О
О О




Ö Ö
Окись азота NО мгновенно окисляется кислородом до NО2, с F2, Cl2, Вг2 образует нитрозилгалогениды NOГ.
Молекулы NO и NO2 довольно легко теряют неспаренный электрон (потенциал ионизации 9,5 и 9,91 эВ соответственно), образуя ионы нитрозония NO+ и нитрония NO2+.
Оксид азота(III) N2O3 при комнатной температуре - малоустойчивое вещество, уже при -100 C образует NO и NO+2:
N2O3 ⇆ NO + NO2,
при -30°C представляет собой синюю жидкость, при -100°С – синие кристаллы, имеющие строение..
O




 :Ö = N -N
:Ö = N -N
O
При пониженных температурах N2O3 в воде образует азотистую кислоту HNО2, которая в свободном состоянии не получена, водные растворы ее неустойчивы и при нагревании разлагаются:
3HNО2 = HNО3 + 2NО + Н2О.
Растворы азотистой кислоты готовят подкислением холодных растворов нитритов:
Ba(NО2)2 + H2SО4 = 2HNО2 + BaSО4.
В газовой фазе, где имеет место равновесие
NО + NО2 + H2О ⇆ 2HNО2,
азотистая кислота присутствует в двух формах



 .. O: + O
.. O: + O

 Н-О-N ⇆ H-N _
Н-О-N ⇆ H-N _
·· ·· O
Ион NO2− в методе валентных связей (ВС) можно рассматривать как резонансные гибриды:

Поскольку в азотистой кислоте азот имеет промежуточную степень окисления (+3), то и кислота, и ее соли нитриты могут быть и восстановите-лями, и окислителями.
Оксиду азота(V) в газовой фазе можно приписать строение

твердый N2O5 представляет собой нитрат нитрония NО2+NО3−.
Оксид N2О5 является ангидридом азотной кислоты
N2О5 + Н2О = 2HNO3.
Безводная HN03 подвергается самоионизации с образованием иона нитрония:
2HNО3 = NО2+ + NО3− + Н2О.
Концентрированная азотная кислота окисляет металлы (за исключением Pt, Rh, Ir и Аu) и неметаллы, пассивирует Fe, Сг, Al. В комплексных соединени-ях нитрат-ион может выступать в качестве моно- или бидентатного лиганда:
[Co(NH3)5NO3]2+, [Ce(NO3)6]2−.
6.2.2. Семинар 7. Азот, соединения азота
1. Получение и свойства молекулярного азота. Проблема связанного азота, круговорот его в природе.
2. Аммиак и его производные - гидразин, гидроксиламин, их соли; получение, сравнение свойств; применение.
3. Азотная кислота, ее соли, получение и свойства. Азотные удобрения.
Упражнения
1. Постройте энергетические диаграммы МО, запишите электронные конфигурации основного состояния молекулы N2, ионов N2+ и N2−. Опреде-лите кратность связи в указанных частицах и сравните их стабильность.
2. Почему для азота в отличие от фосфора, мышьяка и сурьмы не характерна аллотропия?
3. В каком случае можно получить водород при взаимодействии метал-ла с азотной кислотой? Приведите примеры, дайте объяснения.
4. Объясните падение термической устойчивости в ряду безводных нитратов: нитраты щелочных металлов (575-675°С); нитраты щелочно-земельных металлов (560-575°С); нитраты двухвалентных кобальта, никеля, меди, цинка (270-3500С) и бериллия (125°С); нитрат водорода HNО3 разлагается при обычных условиях на свету.
5. Какие свойства гидразина обуславливают возможность применения его в качестве ракетного топлива?
6. Как получается нитроний-ион и какова его роль в реакциях нитрова-ния ароматических углеводородов?
7. Расположите соединения N2H4, NH3, NH2OH, HN3 в ряд по ослаблению основных свойств в водном растворе. Дайте объяснения. Какой из разбавленных растворов одинаковой молярной концентрации указанных веществ имеет наименьшее значение рН?
7. Опишите в рамках модели локализованных атомных орбиталей строе-ние амидного иона NH2. Линейную или изогнутую структуру имеет этот ион?
Литература к семинару
1. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. 4.2. - М.: Мир, 1969. - С. 155 - 193.
2. Спицын В. И., Мартыненко Л. И. Неорганическая химия. 4.1. - М.: МГУ. 1991. - С. 101 - 131.
3. Некрасов Б. В. Основы общей химии. T.1. - М.: Химия, 1973. - С. 382 - 06; 413 - 437.
4. Р е м и Г. Курс неорганической химии. Т.1. - М.: ИЛ, 1963. - С. 633 - 672.
5. А х м е т о в Н. С. Общая и неорганическая химия. - М.: Высшая школа, 1988. - С. 328 - 347.
6. У г а й Я. А. Неорганическая химия. - М.: Высшая школа, 1989. - С. 246 - 268.
7. Анорганикум. Т.1/Под ред. Л. Ко л ьд и ц а, - М.: Мир,1984. - С.529 - 539.
8. X ь ю и Дж. Неорганическая химия. - М.: Химия, 1987. - С. 590 - 592.
9. X а р д и Р., Б о т т о м л и Ф., Берне Р. Проблемы фиксации азота. - М.: Мир, 1982. - 734 с.
10. Коттон Ф., Уилкинсон Дж. Основы неорганической химии. - М.: Мир, 1979. - С. 327 - 339.
11. Кемпбел Дж. Современная общая химии. Ч.1. – М.: Мир, 1975. - С. 432 - 473.
6.2.3. Подготовка к лабораторной работе
1. Написать уравнения реакций термического разложения солей аммо-ния: NH4NO3, NH4NO2, NH4CI, (NH4)2CO3, NH4H2PO4l (NH4)2Cr2O7.Указать, какие реакции разложения протекаю т обратимо, а какие - практически необ-ратимы.
2. Как отличить оксид диазота от кислорода?
3. Что называется "царской водкой", каково ее действие на золото, платину? Привести уравнения реакций.
4. В каких случаях водный раствор аммиака нельзя использовать для осаждения труднорастворимых гидроксидов металлов? Привести примеры.
5. Написать уравнения реакций для трех различных методов получения NO, подобрать коэффициенты.
6. Почему нельзя путем упаривания увеличить концентрацию 70%-ного раствора азотной кислоты? Как это можно сделать?
7. Вычислить рН 0,2 моль/л раствора аммиака (К д = 1,85∙10-5).
8. Какие вещества следует использовать в качестве осушителей газооб-образного аммиака? Какие меры безопасности следует соблюдать при работе с аммиаком?
9. Какую среду имеют водные растворы солей NH4NО3; (NH4)2SО4; NH4CH3COO; (NH4)2CО3?
10. Написать продукты реакций, подобрать коэффициенты:
NH3(г) + СаС12(т) →
NH3(ж) + Na →
Р + НNО3(конц.) →
NH2OH + KMnО4 + H2SО4 →
Zn + НNО3(очень разб.) →
HN3 + KMnО4 + H2SО4 →
N2О4(ж) + N2Н4(ж)
11. Используя закон эквивалентов, определить число граммов HNО3, необходимое для нейтрализации 50,0 г Ва(ОН)2.
12. Все оксиды азота реагируют с раскаленной медью, образуя оксид меди(Н) и свободный азот. Какова формула взятого оксида азота, если масса полученного СuО составляет 0,7105 г и объем азота равен 200 мл (н.у.)?
13. Составить краткий план выполнения лабораторной работы.
6.2.4. Лабораторная работа
Азот, водородные и кислородные соединения азота
Получение и свойства азота
Свободный азот - одно из самых устойчивых химических веществ; его можно получить окислением соединений, где атом азота поляризован отрица-
-з
тельно (NH3); восстановлением соединений, где азот поляризован положитель-
+5
но (NaNО3); за счет внутримолекулярного окислительно-восстановительного процесса (NH4NО2); термическим разложением азида натрия NaN3 или азида бария Ba(N3)2 получают спектроскопически чистый азот.
1.  Получение азота разложением нит-рита аммония. Собрать прибор (рис.18), проверить его на гермитичность. В пробирку 1 внести 3 мл насыщенного раствора NaNO2, из капельной воронки 2 влить 2-3 мл насыщенного раствора NH4Cl. Нагреть смесь до 70-800С, собрать газ в пробирку 3 вытеснением воды, опустить в пробирку горящую лучинку. Что наблюдается? Составить уравнение протекающих реакций. Показать перемещение электронов в NH4NO2 при нагревании.
Получение азота разложением нит-рита аммония. Собрать прибор (рис.18), проверить его на гермитичность. В пробирку 1 внести 3 мл насыщенного раствора NaNO2, из капельной воронки 2 влить 2-3 мл насыщенного раствора NH4Cl. Нагреть смесь до 70-800С, собрать газ в пробирку 3 вытеснением воды, опустить в пробирку горящую лучинку. Что наблюдается? Составить уравнение протекающих реакций. Показать перемещение электронов в NH4NO2 при нагревании.
Рис. 18. Прибор для получения азота
2. Получение азота окислением аммиака. В пробирку 1 (рис.18) внести 1,5-2 г хлорной извести, из капельной воронки 2 по каплям прилить 4-5 мл концентрированного раствора аммиака. Выделяющийся газ собрать в пробир-ку над водой, проверить, поддерживает ли он горение. Записать свои наблюдения. Уравнение реакции уравнять методом полуреакций, указать окислитель и восстановитель.
3. Получение азота восстановлением нитрата. Поместить в сухую про-бирку 1-2 микрошпателя порошкообразного железа и 2-3 микрошпателя KNO3, смесь перемешать.
Рис. 19. Прибор для получения азота восстановлением нитрата
 Пробирку закрыть пробкой с загнутой кверху отводной трубкой, укрепить в штативе (рис. 19) и слегка нагреть. В собранный над водой газ внести зажженную лучинку, записать наблюдения и уравнение реакции.
Пробирку закрыть пробкой с загнутой кверху отводной трубкой, укрепить в штативе (рис. 19) и слегка нагреть. В собранный над водой газ внести зажженную лучинку, записать наблюдения и уравнение реакции.
4. Окислительные свойства азота. Получение нитрида магния (опыт выполняется двумя студентами). Собрать прибор (рис. 20). В цилиндричес-ческую пробирку 1 насыпать смесь измельченных кристаллов бихромата калия (~ 4 г) и сульфата аммония (~ 2 г). Трубку 2 наполнить безводным просушенным CaCl2, в тугоплавкую трубку 3 поместить порошок магния (~ 0,5 г). Пробирку 1 осторожно нагреть на маленьком пламени горелки. Одновременно другой горелкой сначала осторожно, а затем сильнее в тече-ние 5-7 мин нагревать в токе азота порошок магния в трубке 3. После этого трубку охладить, отсоединить ее от прибора и извлечь полученный нитрид магния в пробирку, в которую внести затем несколько капель воды. Определить по запаху выделение аммиака, подержать над пробиркой влажную лакмусовую бумажку. Записать наблюдаемое и уравнения реакций. Какие свойства проявляет азот в реакции с магнием? Какую степень окисления имеет атом азота в нитриде магния Mg2N3? Какой реакцией подтверждается это?

Рис.20. Прибор для получения нитрида магния
Получение аммиака, его свойства. Соли аммония
5. Получение аммиака вытеснением его из раствора соли аммония силь-ным основанием. В пробирку внести 2–3 капли раствора соли аммония, доба-вить столько же 1 моль/л раствора едкого натра(или калия). Слегка нагреть пробирку и над ее отверстием подержать влажную красную лакмусовую бу-мажку. По запаху и по изменению цвета лакмусовой бумажки убедиться в выделении аммиака и образовании ОН− -иона при его взаимодействии с водой.
6. Получение аммиака вытеснением из солей аммония сильным основанием при нагревании. В сухую пробирку 1 (рис.21) всыпать тщательно перемешанную смесь из 1–2 г хлорида аммония и 1–1,5 г гидроксида кальция, закрыть смесь тампоном из стекловаты, часть пространства пробирки заполнить небольшими кусочками оксида кальция (для чего?), закрыть пробирку пробкой с загнутой кверху газоотводной трубкой и укрепить в штативе.
На газоотводную трубку надеть сухую пробирку 2 для сбора аммиака, смесь осто-рожно нагреть. После наполнения пробир-ки аммиаком, не поварачивая, снять ее с трубку и закрыть пробкой, сохранить со-держимое пробирки для последующих опытов. Поднести к концу отводной труб-ки лакмусовую бумажку, смоченную во-дой, затем стеклянную палочку, смоченyю

Рис.21. Прибор для получения аммиака
концентрированной соляной кислотой. Записать наблюдаемые явления и объяснить их.
7. Смещение равновесия в системе аммиак – вода. Полученный в преды-
дущем опыте аммиак растворить в воде, раствор разлить в три пробирки. В две из них добавить по одной капле фенолфталеина; отметить окраску растворов и указать характер среды. Первую пробирку нагреть, а во вторую – внести 3–4 микрошпателя NH4CI, перемешать раствор, отметить изменение интенсивности окраски индикатора в обеих пробирках. К раствору аммиака в третьей пробирке по каплям прибавлять раствор Al2(SО4)3 до исчезновения запаха аммиака. Что наблюдается в третьей пробирке? Указать, в каком направлении и почему сдвигается равновесие в водном растворе аммиака
NH3 + H2O ⇆ NH4OH ⇆ NH4+ + OH−
при нагревании, при добавлении хлорида аммония или сульфата
алюминия. В каком направлении и почему сместится равновесие в
данной системе при добавлении раствора HCI?
8. Восстановительные свойства аммиака. В три пробирки внести раз-дельно по 3–4 капли растворов: а) бромной воды; б) перманганата калия; в) бихромата калия. В каждую из пробирок добавить по 3–5 капель 25%-ного раствора аммиака, растворы слегка подогреть до изменения их окраски. Написать уравнения соответствующих реакций, уравнять их методом полуреакций. Учесть, что аммиак в каждом случае окисляется до свободного азота, КМnО4 – восстанавливается до МnО2, а К2Сг2О7 – до Сг(ОН)3.
9. Донорные свойства аммиака, получение аммиаката никеля (II). К 1–2 мл раствора NiSО4 по каплям приливать разбавленный раствор аммиака до изменения окраски раствора. Каковы состав, окраска аммиакатного комплекса никеля в растворе? Записать выражение общей константы устойчивости комплексного катиона.
10. Получение солей аммония. Смочить дно и стенки стакана несколькими каплями концентрированной соляной кислоты. Стаканом накрыть тигель, содержащий 5–6 капель концентрированного раствора аммиака. Что наблюдается?
11. Гидролиз солей аммония. В три пробирки налить по 5–6 капель нейтрального раствора лакмуса, добавить в них по 2–3 микрошпателя кристаллов хлорида, нитрата и ацетата аммония растворы Перемешать. Отметить изменение окраски лакмуса в каждом случае. Написать в молекулярном и ионном виде соответствующие уравнения реакций гидролиза солей, указать среду раствора.
12. Отношение к нагреванию солей аммония. В четыре сухие пробирки поместить соответственно по 3–4 микрошпателя NН4CI, NH4H2PO4, (NH4)2CО3, (NH4)2Cr2О7. Закрепить поочередно пробирки в штативе и нагреть. Обратить внимание на образование белого налета на холодных стенках верхней части первой пробирки. Установить, какой газ выделяется при нагревании солей во второй и третьей пробирках. Объяснить бурное протекание реакции в четвертой пробирке. Как влияет природа аниона на характер термического разложения солей аммония? Какие соли аммония
возгоняются?
Свойства гидразина и гидроксиламина
Гидразин и гидроксиламин являются более слабыми основаниями, чем аммиак. Объясните этот факт.
13. Кислотно-основные свойства гидразина. С помощью универсального индикатора определить рН разбавленного раствора гидразингидрата. Сравнить среду растворов
Дата публикования: 2014-10-23; Прочитано: 5615 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
