 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример расчета
|
|
Данные определения действующей субстанции в пробе лекарственного препарата представлены в таблице.
| № | X(%) | Xi- 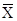 (X- (X- 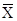 )2 )2
| |
| 96,6 | +0,6 | 0,36 | |
| 95,4 | -0,6 | 0,36 | |
| 95,5 | -0,5 | 0,25 | |
| 96,5 | +0,5 | 0,25 | |
| 96,1 | +0,1 | 0,01 | |
| 95,9 | -0,1 | 0,01 | |
| 94,1 |


Проверим на промах величину, наиболее отличающуюся от результатов всей серии - 94,1%.
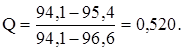
Табличные значения Q для n=7 и Р=95% - 0,480, следовательно, это значение является промахом и не включается в расчет среднего арифметического значения.



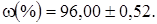
Тема II. Титриметрический анализ. Классификация методов. Способы выражения концентрации растворов и их взаимосвязь. Приемы и способы титрования: прямое, по остатку, обратное. Закон эквивалентов. Расчеты в титриметрическом методе анализа.
При изучении данной темы основное внимание следует обратить на классификацию методов объемного анализа по типу химической реакции, лежащей в основе титрования, не путать реакцию, определяющую титрование и лежащую в основе пробоподготовки. Так как в титриметрии используют стандартные растворы титрантов с известной концентрацией, важно твердо знать способы выражения концентраций и уметь делать пересчеты концентраций и расчеты, связанные с приготовлением стандартных растворов и их разбавлением. В аналитической химии используют следующие способы выражения концентраций: молярная, молярная концентрация эквивалента, титр и титр по определяемому веществу. В таблице 2 приведены основные способы выражения концентраций, их обозначения и пересчеты одной концентрации в другую.
Таблица 2 - Способы выражения концентрации растворов в аналитической химии и их взаимосвязь (объем раствора V в мл; масса вещества m в г)
| Наименование концентрации | Обозначение | Единица измерения | Формула для расчета концентрации | Расчет количества вещества эквивалента, моль |
| Массовая доля | ω(A) | % | 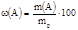 
|
Молярная C(A) моль/л (ммоль/мл) 
 
|
Молярная концентрация эквивалента C(1/zA) моль/л 
 
| ||||
| Титр | T(A) | г/мл |  
|
Титр по определяемому веществу T(A/B) г/мл 
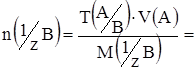
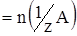
|

В основе всех количественных расчетов результатов анализа лежит закон эквивалентов. Число молей эквивалентов определяемого вещества равно числу молей эквивалентов титранта. Важно правильно определять фактор эквивалентности веществ, реагирующих в процессе титрования, так как условия титрования могут быть различными. Например, в кислотно-основном методе фактор эквивалентности может определяться используемым индикатором. Следует различать, какой метод: прямого титрования или титрования по избытку - используется в данном определении. В прямом титровании всегда используют один стандартный раствор - титрант, в методе обратного титрования - два титранта. Определив способ титрования, соответствующим образом составляется выражение закона эквивалентов. Число молей эквивалентов титранта целесообразно определять, используя заданную концентрацию титранта, титр или титр по определяемому веществу, не проводя лишних пересчетов от одной концентрации к другой. Все расчеты в объемном анализе проводят с точностью в четыре значащие цифры.
Пример 1. Из 2,500 г Na2CO3 приготовили 500,0 мл раствора. Рассчитать для этого раствора: а) молярную концентрацию, б) молярную концентрацию эквивалента, в) титр, г) титр по HCl.
Решение:
а) Молярная концентрация - это количество молей вещества, содержащееся в 1 литре раствора. n (Na2CO3) в 500 мл. Тогда в 1 литре или в 1000 мл содержится:

Таким образом, С(Na2CO3)=0,04717 моль/л.
б) Если не оговорено особо, то в основе титрования предполагается реакция:2CO3 + 2HCl = 2NaCl + H2CO3
и фактор эквивалентности равен 1/2.
Молярная масса эквивалента, следовательно, равна 1/2М(Na2CO3).
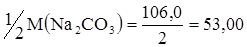

или
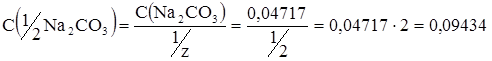 .
.
в) По определению титр - это масса вещества в граммах, содержащаяся в 1 мл раствора. Тогда

г) Титр по определяемому веществу - это количество граммов определяемого вещества, которое эквивалентно 1 мл раствора соды.
Титр раствора Na2CO3 по HCl можно рассчитать, например, исходя из молярной концентрации эквивалента раствора Na2CO3.(1/2Na2CO3) - число молей эквивалентов Na2CO3 в 1 литре или 1000 мл раствора,(1/2Na2CO3)/1000 - число молей эквивалентов Na2CO3 в 1 мл раствора.
По закону эквивалентов столько же эквивалентов HCl соответствует 1 мл раствора соды.
[C(1/2Na2CO3)/1000]∙M(HCl) - масса HCl в граммах, соответствующая 1 мл раствора Na2CO3, т.е.
 г/мл.
г/мл.
Пример 2. Определить массу Na2CO3 в 250,0 мл раствора, если на титрование 25,00 мл этого раствора с индикатором метиловым оранжевым израсходовано 20,20 мл раствора HCl с концентрацией 0,1010 моль/л.
Дата публикования: 2014-11-18; Прочитано: 1897 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
