 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема I. Качественный анализ - дробный и систематический
|
|
При выполнении задания по этой теме необходимо знать кислотно-основную классификацию катионов на аналитические группы и групповые реагенты, уметь писать уравнения аналитических реакций в молекулярной и ионной формах, полной и сокращенной. При написании реакций обнаружения катионов обратить особое внимание на условия их выполнения и мешающее действие других ионов.
В данных методических указаниях и методических указаниях кафедры по качественному анализу изучение свойств катионов основано на кислотно-основной классификации катионов, согласно которой необходимо выполнять задание по составлению хода анализа.
Таблица 1 - Кислотно-основная классификация катионов
| Номер группы | Групповой реагент | Катионы | Продукты взаимодействия и их свойства |
| I | Отсутствует | Li+, Na+, K+, NH4+ | Отсутствуют |
| II | HCl | Ag+, Pb2+, [Hg2]2+ | AgCl (т), PbCl2 (т), Hg2Cl2 (т). Осадки не растворяются в разбавленных кислотах |
| III | H2SO4 | Ca2+, Sr2+, Ba2+ | CaSO4 (т), BaSO4 (т), SrSO4 (т). Осадки не растворяются в кислотах, щелочах, аммиаке |
| IV | NaOH (избыток) | Zn2+, Al3+, Cr3+, Sn(II), Sn(IV), As(III), As(V) | ZnO22-, AlO2-,CrO2-,SnO22-, SnO32-, AsO33-, AsO43- (ионы в растворе)* |
| V | NaOH | Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb(III), Sb(V) | Mg(OH)2 (т), Mn(OH)2 (т), Fe(OH)2 (т), Fe(OH)3 (т), Bi(OH)3 (т), HSbO2 (т), HsbO3 (т). Осадки не растворяются в избытке щелочи и аммиака |
| VI | 25%-ный раствор NH3 | Co2+, Ni2+, Cu2+, Cd2+, Hg2+ | [Co(NH3)6]2+, [Ni(NH3)6]2+, [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+ (ионы в растворе) |
* Более вероятно образование комплексных ионов, например [Zn(OH)4]2- и т.д., кроме мышьяка.
Перед выполнением систематического анализа необходимо проводить предварительные испытания, т.е. исследования, по которым можно судить о составе раствора или сухого вещества ориентировочно. Следует отметить цвет, определить рН (раствора), а при наличии сухого вещества или осадка в растворе выяснить, в каком растворителе он может полностью или частично раствориться. Затем выполняют обнаружения дробным методом (из отдельных порций раствора), так как на некоторые ионы существуют специфические реагенты (или создаются специфические условия) и нет необходимости проводить обнаружение их систематическим методом. Это особенно касается тех ионов, которые могут в процессе анализа изменить степень окисления или соосадиться и быть «потерянными». Однако не следует подменять дробным анализом систематический, являющийся в отличие от первого универсальным. Заключения по предварительным испытаниям и дробным обнаружениям позволяют выбрать наиболее оптимальный ход систематического анализа, провести его быстрее, а результаты получить более надежными.
Систематический ход анализа по кислотно-основной классификации см. в учебнике по аналитической химии, например: Харитонов Ю.Я. Аналитическая химия. Ч.1 - М.: Высшая школа, 2001.
Тема II. Гомогенные равновесия. Теория электролитической диссоциации. Расчет pH в растворах сильных и слабых кислот и оснований. Химическое равновесие. Закон действующих масс. Буферные растворы, расчет pH в буферных растворах.
При выполнении задания по этой теме важно правильно применять основные положения теории электролитической диссоциации для написания уравнений диссоциации сильных и слабых электролитов Используя константы кислотности (Ка) и основности (Кв) необходимо уметь выводить формулы для расчета [Н+], [ОН-] и рН, рОН в растворах слабых кислот и оснований, а также в присутствии их солей. Следует изучить механизм действия буферных растворов и использование их в систематическом ходе анализа.
Пример 1. Рассчитать рН в 0,025 М растворе хлороводородной кислоты.
Решение:
HCl↔H++Cl-
[Н+] = c(HCl) = 0,025 моль/л
рН = -lg[Н+] = -lg0,025 = 1,6.
Пример 2. Рассчитать рН 0,015 М раствора муравьиной кислоты. Как изменится рН, если к 20 мл этого раствора прибавить 25 мл 0,01 М раствора формиата натрия?
Решение:
НСООН→НСОО-+Н+
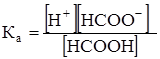
До добавления формиата натрия [Н+] = [НСOO-]
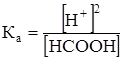
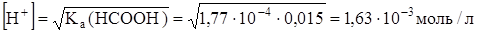
рН = -lg[Н+] = 2,79.
Рассчитаем концентрации муравьиной кислоты и формиата натрия после смешивания растворов:
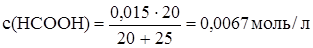
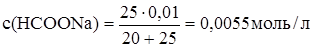
При добавлении формиата натрия диссоциация муравьиной кислоты подавлена, следовательно [HCOO-]=c(HCOONa)=0,0055 моль/л
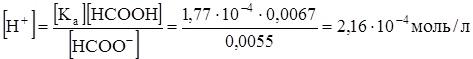
рН=3,67.
При добавлении формиата натрия рН раствора повышается за счет подавления диссоциации муравьиной кислоты в присутствии одноименного иона.
Дата публикования: 2014-11-18; Прочитано: 766 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
