 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема III. Протолитические равновесия в растворах солей. Степень и константа гидролиза. Расчет рН в растворах гидролизующихся солей
|
|
В водных растворах соли, содержащие катионы слабых оснований, и анионы слабых кислот подвергаются гидролизу, то есть взаимодействуют с протонами или гидроксильными группами нейтральных молекул воды. В растворах устанавливается гидролитическое равновесие, которое характеризуется константой гидролиза (Кh). При изучении этой темы необходимо обратить внимание на правильное написание уравнений реакций гидролиза в ионном виде и выражение константы гидролиза. Уметь выводить расчетные формулы степени гидролиза (h) и рН растворов гидролизующихся солей, знать факторы, влияющие на гидролиз.
Пример 1. Вычислить [H+] и pH 0,005 M NH4NO3, а также степень и константу гидролиза NH4NO3.
Решение: Составляем уравнение реакции гидролиза:
NH4+ + H2O = NH4OH + H+.
Рассчитываем концентрацию H+-ионов по формуле:
 .
.

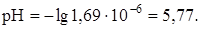
Степень гидролиза h рассчитываем по формуле: 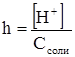
 .
.
Константу гидролиза Кг рассчитываем по формуле: 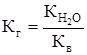
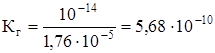 .
.
Тема IV. Гетерогенные равновесия в аналитической химии. Произведение растворимости (константа растворимости). Условия образования осадков. Влияние на полноту осаждения одноименного иона, рН раствора, постороннего электролита («солевой эффект»).
Гетерогенные равновесия устанавливаются на границе раздела фаз (осадок - насыщенный раствор над осадком). Данное равновесие характеризует константа растворимости (Ks) или произведение растворимости (ПР). Используя значения ПР (Ks) необходимо уметь рассчитывать молярные (моль/л) и массовые (г/л) концентрации ионов в растворе малорастворимого соединения в воде и в присутствии одноименных ионов. Следует знать условие образования осадков и уметь решать вопрос о возможности их образования при смешивании растворов.
Пример 1. Рассчитать молярную (моль/л) и массовую (г/л) растворимость сульфата кальция, если ПP(CaSO4)=2,5·10-5.
Решение:
Запишем равновесие в рассматриваемой системе:
CaSO4→Са2+ + SO42-.
Обозначим молярную концентрацию соли в насыщенном растворе (растворимость) - s (моль/л), тогда [Са2+] = [SO42-] = s.
Запишем выражение ПР:
ПР=[Са2+][SO42-] = s2,  .
.
Массовая растворимость сульфата кальция будет равна:
S(г/л)=s(моль/л)·M(CaSO4)=5·10-3·136=0,68 г/л.
Дата публикования: 2014-11-18; Прочитано: 1781 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
