 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема V. Равновесия в растворах комплексных соединений. Константы устойчивости и нестойкости. Влияние избытка лиганда, разрушение комплексных соединений
|
|
В водных растворах комплексных соединений устанавливается равновесие, которое характеризуется константой устойчивости (Куст.) или величиной, обратной ей, константой нестойкости (Кн). Пользуясь величиной соответствующей константы, необходимо уметь рассчитывать равновесные концентрации ионов в растворе комплексных соединений в присутствии избытка лиганда и без избытка лиганда. Следует знать способы разрушения комплексов и уметь проводить расчеты, связанные с разрушением комплексов за счет образования малорастворимых соединений.
Пример 1. Рассчитать равновесную концентрацию ионов Zn2+ в 1 М растворе [Zn(NH3)4]Cl2lgКуст. = 8,7.
Решение:
[Zn(HN3)4]Cl2→[Zn(HN3)4]2+ + 2Cl-
[Zn(HN3)4]↔ Zn2+ + 4NH3

Куст. = 108,7 = 2,0·109.
Обозначим [Zn2+]=x моль/л, тогда [NH3]=4x моль/л. Величина х<<1, ею можно пренебречь, поэтому равновесная концентрация [Zn(NH3)4]2+ = c([Zn(NH3)4]2+) = 1 моль/л. Подставим равновесные концентрации ионов в выражение константы устойчивости:

 .
.
Пример 2. Будет ли выпадать осадок оксалата цинка при добавлении к 0,001 М раствору [Zn(NH3)4]2+ 0,1 моль/л оксалата натрия, если равновесная концентрация аммиака в растворе составляет 0,1 моль/л?
ПР(ZnC2O4) = 2,75·10-8, Куст.([Zn(NH3)4]2+) = 2,0·109
Решение: Осадок будет образовываться, если выполняется условие: ПКИ>ПР
ПКИ = с(Zn2+) с(CO2O42-)
c(CO2O42-) = c(Na2C2O4) = 0,1 моль/л.
Равновесную концентрацию ионов цинка рассчитаем из константы устойчивости аммиакатного комплекса цинка [Zn(NH3)4]2+↔Zn2+ + 4NH3

В растворе присутствует избыток аммиака, следовательно, равновесие сдвинуто в сторону образования комплекса, диссоциация комплекса подавлена [NH3] = 0,1 моль/л.

ПКИ = 0,1·5·10-9 = 5·10-10
ПКИ<ПР, осадок в данных условиях не образуется.
Тема VI. Окислительно-восстановительные системы. Стандартный и реальный окислительно-восстановительные потенциалы. Уравнение Нернста. Влияние рН комплексообразования и осаждения на величину окислительно-восстановительного потенциала. Направление, последовательность протекания и константа равновесия окислительно-восстановительных реакций.
Количественной характеристикой окислительно-восстановительной способности редокс-пары являются значения стандартного и реального окислительно-восстановительного потенциала. Реальный окислительно-восстановительный потенциал рассчитывается по уравнению Нернста. При изучении этой темы следует обратить внимание на правильное написание уравнения Нернста для различных случаев окислительно-восстановительных систем: с участием твердых веществ, с участием ионов водорода и гидроксид-ионов и т.д., а также на расчет потенциала с учетом равновесных концентраций. Уравнения окислительно-восстановительных реакций необходимо составлять электронно-ионным методом. Молекулярные уравнения составлять не следует. На основании стандартных окислительно-восстановительных потенциалов уметь определять направление протекания реакций. Обратить особое внимание, как меняется величина потенциала системы при образовании комплексного и малорастворимого соединения.
Пример 1. Составить уравнение реакции между перманганат-ионом и пероксидом водорода в кислой среде электронно-ионным методом и записать уравнения Нернста для окислительно-восстановительных систем.
Решение:
MnO4- + 8H+ + 5e → Mn2+ + H2O x2
Н2О2 - 2е → O2 + 2H+ x5
2МnО4- + 5Н2О2 + 6H+ → 2Mn2+ + 5О2 + 8Н2О
Составляем уравнения Нернста для окислительно-восстановительных систем:


Пример 2. Можно ли в кислой среде действием дихромата калия окислить: a) Fe2+ до Fe3+; б) Мn2+ до МnО4-?
Решение: Для решения вопроса необходимо сравнить стандартные окислительно-восстановительные потенциалы окислительно-восстановительных систем. Более сильным окислителем будет окисленная форма той системы, стандартный окислительно-восстановительный потенциал которой больше.

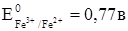
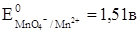
Потенциал системы Cr2O72-/Cr3+, больше, чем потенциал системы Fe3+/Fe2+ и меньше, чем потенциал системы МnО4-/Мn2+, следовательно, Fe2+ можно окислить до Fe3+ действием дихромата калия, а Мn2+ до МnО4- не окисляется.
5. КОНТРОЛЬНЫЕ ЗАДАНИЯ по теме «Теоретические основы аналитической химии и качественный анализ» (контрольная работа № 1)
. По каким принципам объединяют вещества в аналитические группы? Групповые реагенты и группы катионов в кислотно-основном методе анализа.
. Составьте схемы дробного и систематического анализа смеси катионов: Pb2+, Al3+, Fe3+, Ni2+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
. Можно ли действием дихромата калия в кислой среде окислить Fe2+ до Fe3+, AsО33- до AsО43-, Мn2+ до МnО4-, SО32- до SО42-, SО42- до S2О82-. Написать уравнения протекающих реакций с помощью электронно-ионного метода.
. Составьте схемы дробного и систематического анализа смеси катионов: NH4+, Ca2+, Mn2+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
. Составьте схемы дробного и систематического анализа смеси катионов: Ag+, Cu2+, Fe3+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
. К раствору, содержащему ионы AsО33- и SО32-, в кислой среде добавили пероксид водорода. Какой из этих анионов будет окисляться в первую очередь? Написать реакции окисления-восстановления и уравнять их электронно-ионным методом.
. Составьте уравнения окислительно-восстановительных реакций электронно-ионным методом, если на раствор, содержащий ион марганца (II), подействовали: а) висмутатом натрия в присутствии азотной кислоты, б) пероксидисульфатом аммония, в) оксидом свинца (IV).
. Смесь сухих солей: нитрат ртути (I), хлорид хрома (III), нитрат цинка растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в растворе катионов.
. Составьте уравнения реакций в ионном виде, происходящие при действии иодида калия на раствор, содержащий: a) Bi(NO3)3, б) CuCl2, в) Na2HAsO4.
. Смесь сухих солей: нитрат серебра, нитрат ртути (П), хлорид хрома (III), нитрат марганца (II), нитрат свинца растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
. Смесь сухих солей: нитрат серебра, хлорид бария, нитрат хрома (III), хлорид сурьмы (III) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
. Составьте уравнения окислительно-восстановительных реакций электронно-ионным методом, если на раствор, содержащий а) ионы Cr3+, подействовать пероксидом водорода в щелочной среде, б) ионы Cr2O72-, подействовать пероксидом водорода в кислой среде.
. Смесь сухих солей: сульфат калия (недостаток), хлорид аммония, нитрат стронция, хлорид кальция, хлорид бария растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
. Смесь сухих солей: сульфат калия, хлорид аммония, нитрат стронция, хлорид кальция, хлорид бария растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
. Составьте уравнения реакций в ионном виде, если на раствор, содержащий ионы Pb2+, Sn2+, Al3+, Zn2+, Cd2+, подействовали: а) избытком гидроксида натрия, б) избытком раствора аммиака.
. Смесь сухих солей: карбонат калия, хлорид хрома (III), хлорид железа (III), нитрат меди (II) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов и анионов.
. Составьте уравнения окислительно-восстановительных реакций электронно-ионным методом, если на раствор, содержащий ионы хрома (III), подействовали: а) раствором перманганата калия в кислой среде, б) бромом в щелочной среде.
. Смесь сухих солей: хлорид сурьмы (III), нитрат висмута, нитрат свинца (II), хлорид марганца (II), хлорид меди (II) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа и уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
. Рассчитать константу гидролиза, степень гидролиза и рН в 0,09 M растворе бромида аммония. Выведите формулы для расчета.
. Рассчитайте равновесные концентрации ионов железа (III) и фторид-ионов в водном растворе, содержащем комплекс К3[FeF6] с концентрацией 0,1 моль/л. Полная константа нестойкости комплексного аниона [FeF6]3- равна 10-16,1.
Ответ: [Fe3+]=7,76·10-4 моль/л; [Fe-]=4,66·10-3 моль/л.
. Рассчитайте концентрационные константы устойчивости b и нестойкости КН комплексного аниона [PbJ4]2-, если в водном 1,0 моль/л растворе комплекса К2[PbJ4] равновесные концентрации ионов свинца (II) и иодид ионов равны: [Pb2+] = 0,054 моль/л, [J-] = 0,216 моль/л.
Ответ: b=8,51·103, КН=1,18·10-4.
. В 12 л воды растворили 0,01 г бромида калия и прибавили 1 мл 0,1 М раствора нитрата серебра. Будет ли образовываться осадок бромида серебра?
. Рассчитать молярную растворимость (моль/л) и массовую растворимость (г/л) фосфата бария в 0,025 М растворе фосфата натрия.
. Образуется ли осадок сульфата свинца, если к насыщенному раствору хлорида свинца прибавить равный объем 0,2 М раствора серной кислоты.
. Выпадет ли осадок сульфата бария, если смешать 0,15 мл 0,1 М раствора сульфата натрия и 2 мл 0,001 М раствора хлорида бария?
. Рассчитать сколько молей серебра находится в 500 мл насыщенного раствора хромата серебра.
. Рассчитать молярную (моль/л) и массовую (г/л) растворимость сульфата кальция.
. Рассчитать растворимость фосфата серебра в 0,05 М растворе нитрата калия.
. Рассчитайте рН водного раствора, содержащего в 1 л 3,0 г ортоборной кислоты H3BO3. Константа диссоциации этой кислоты по первой ступени KI = 7,1·10-10; pKI = 9,15.
Ответ: рН = 5,23.
. Рассчитайте ионную силу растворов, содержащих в 1 л: а) 0,01 моль калия хлорида КСl; б) 0,01 моль железа (III) FeCl3; в) 0,01 моль алюминия сульфата Al2(SO4)3.
Ответ: 0,01; 0,06; 0,15.
. Рассчитайте ионную cилу водного раствора, содержащего в 1 л по 0,05 моль стронция нитрата Sr(NO3)2, калия хлорида KCl и уксусной кислоты CH3COOH.
Ответ: 0,2.
. Сколько граммов хлорида аммония нужно прибавить к 500 мл 0,137 М раствора гидроксида натрия, чтобы получить раствор с рН 10,3?
. Чему равна концентрация ионов водорода в 0,05 М растворе бензойной кислоты? Во сколько раз присутствие 0,1 М бензоата натрия понижает эту концентрацию?
. При какой концентрации сульфид-иона начнется выпадение осадка сульфида кадмия из раствора, содержащего 0,05 моль/л [Cd(CN)4]2- и 0,1 моль/л цианида калия.
. Рассчитать концентрацию бромид-ионов в 0,002 М растворе аммиачного комплекса серебра [Ag(NH3)2]+, содержащем 0,005 моль/л аммиака, которую надо создать, чтобы образовался осадок бромида серебра.
. Буферный раствор содержит 0,5 моль/л гидроксида аммония и 0,25 моль/л нитрата аммония. Рассчитать рН раствора. Как изменится рН этого раствора при добавлении к 1 л а) 0,2 моль хлороводородной кислоты, б) 0,25 моль гидроксида натрия?
. Вычислите константы устойчивости b и нестойкости КН комплексного катиона [Co(NH3)6]3+ в водном растворе, если равновесные концентрации реагентов в этом растворе равны: [Co(NH3)6]3+=0,10, [Co3+]=1,5·10-6, [NH3]=9,0·10-6 моль/л. Ответ: b=1,3·1035, КН=7,7·10-36.
. Образуется ли осадок сульфата стронция, если к 02 М раствору хлорида стронция прибавить равный объем сульфата кальция?
. Определите объем 25, 10,%-го водного раствора гидроксида натрия, необходимого для растворения 9,94 г гидроксида цинка Zn(OH)2. Плотность указанного раствора гидроксида натрия равна 1,275 г/мл при температуре 200 С. Ответ: 25 мл.
. Выясните, образуется ли осадок иодида серебра AgJ, если к водному раствору комплекса [Ag(NH3)2]NO3 с концентрацией 0,2 моль/л прибавить равный объем 0,2 моль/л водного раствора иодида натрия NaJ. Полная константа нестойкости комплексного катиона [Ag(NH3)2]+=10-7,23. Произведение растворимости иодида серебра = 8,3·10-17.
Ответ: образуется.
. Определите, как изменится равновесная концентрация ионов цинка в 1,0 моль/л водном растворе комплекса Na2[Zn(OH)4], если рН раствора увеличить от 11 до 12. Полная константа нестойкости комплексного аниона равна 10-14.
Ответ: уменьшится в 104 раз.
. Рассчитайте равновесную концентрацию ионов алюминия в 1,0 моль/л водном растворе комплекса Na[Al(OH)4] при рН=11. Полная константа нестойкости комплексного аниона равна 10-33.
Ответ: 10-21 моль/л.
. Рассчитайте равновесную концентрацию ионов кадмия [Cd2+] в 0,1 моль/л водном растворе комплекса К2[Cd(CN)4], содержащем цианид калия КCN при концентрации c(KCN)=1,0 моль/л. Полная константа нестойкости комплексного аниона [Cd(CN)4]2- равна 10-17,11, pK=17,11.
Ответ: 7,8∙10-19 моль/л.
. Рассчитайте равновесные концентрации ионов меди (II) [Cu2+] и аммиака [NH3] в водном растворе комплекса [Cu(NH3)4]2+ с его исходной концентрацией 0,1 моль/л. Полная концентрационная константа нестойкости комплексного катиона [Cu(NH3)4]2+ равна 10-12,03, рК=12,03.
Ответ: [Cu2+]=8∙10-4 моль/л, [NH3]=3,2∙10-3 моль/л.
. В водном растворе присутствуют сульфат-ион SO42- и оксалат-ион C2O42- в одинаковых концентрациях. К этому раствору медленно прибавляют водный раствор хлорида кальция CaCl2. В какой последовательности будут осаждаться из раствора сульфат-ион и оксалат-ион?
. Как изменится растворимость оксалата кальция при прибавлении в его насыщенный водный раствор хлорида калия KCl до концентрации с(KCl)=0,1 моль/л? Произведение растворимости оксалата кальция равно 2,3∙10-9.
Ответ: увеличится в 2,3 раза.
. Рассчитайте произведение растворимости свежеосажденного гидроксида магния Mg(OH)2, если в 500 мл его насыщенного раствора содержится 1,55∙10-2 г этого соединения.
Ответ: 6,01∙10-10.
. Рассчитайте концентрацию формиат-ионов HCOO- в водном растворе муравьиной кислоты НСООН с концентрацией кислоты, равной 0,05 моль/л. Константа диссоциации муравьиной кислоты равна 1,8∙10-4.
Ответ: 3∙10-3 моль/л.
. Какая масса свинца (в г) содержится в 1 л насыщенного водного раствора сульфата свинца PbSO4, если его произведение растворимости равно 1,6∙10-8.
Ответ: 2,61∙10-2 г.
. Рассчитайте константу гидролиза, степень гидролиза и рН водного раствора ацетата натрия CH3COONa с концентрацией c(CH3COONa)=0,1 моль/л. Константа диссоциации уксусной кислоты равна Кa=1,74∙10-5; рКa=4,76.
Ответ: 5,7∙10-10.
. Рассчитайте рН буферного раствора, один литр которого содержит 0,1 моль уксусной кислоты и 0,01 моль ацетата натрия. Константа диссоциации уксусной кислоты Ка=1,74∙10-5; рКа=4,76.
Ответ: рН=3,76.
. Рассчитайте значение рН водного раствора ацетата аммония CH3COONH4 при концентрации последнего, равной 0,01 моль/л. Для уксусной кислоты Ка=1,74∙10-5; рКа=4,76; для аммиака Кв=1,76∙10-5 и рКв=4,76.
Ответ: pH=7.
. Рассчитайте отношение молярных концентраций муравьиной кислоты HCOOH и ее натриевой соли HCOONa в формиатном буферном растворе, имеющем pН=3,15. Константа ионизации муравьиной кислоты равна Ка = 1,8∙10-4; рКа=3,75.
Ответ: Са/Св=4.
. Определите, как изменится рН водного раствора формиата натрия HCOONa с концентрацией с(HCOONa)=0,10 моль/л, если раствор разбавить водой в 10 раз. Константа кислотности муравьиной кислоты Ка=1,8∙10-4, рКа=3,75.
Ответ: уменьшится на 0,5 единиц.
. Рассчитайте значение рН водного раствора цианида аммония NH4CN, гидролизующегося по катиону и аниону. Концентрация раствора равна 0,1 моль/л. Для синильной кислоты HCN и аммиака, образующихся при гидролизе, pКа=9,3 и рКв=4,76 соответственно.
Ответ: 9,27.
. Рассчитайте рН аммиачного буфера, в 1 л которого содержатся 0,1 моль аммиака и 0,2 моль нитрата аммония NH4NO3. Константа основности аммиака Кв=1,76∙10-5; рКв=4,76.
Ответ: 8,93.
. Рассчитайте произведение растворимости магнийаммонийфосфата NH4MgPO4, если в 1 л его насыщенного раствора содержится 8,6∙10-3 г NH4MgPO4.
Ответ: 2,5∙10-13.
. Рассчитайте молярную концентрацию катионов свинца [Pb2+] и иодид-ионов [J-] в насыщенном растворе иодида свинца PbJ2, если его произведение растворимости равно 1,1∙10-9.
Ответ: [Pb2+]=6,5∙10-4, [J-]=1,3∙10-3.
. Образуется ли осадок сульфата стронция SrSO4 при смешивании равных объемов водных растворов хлорида стронция SrCl2 и сульфата калия K2SO4, если их исходные молярные концентрации составляют 5∙10-4 моль/л? Произведение растворимости сульфата стронция равно 3,2∙10-7.
Ответ: не образуется.
. Как изменится молярная растворимость иодида серебра, если к его насыщенному раствору прибавить иодид калия до концентрации c(KJ)=1,0∙10-4 моль/л? ПРAgJ=8,3∙10-17.
Ответ: уменьшится в 1,1∙10-4 раза.
. Рассчитайте буферную емкость b аммиачного буфера, если при прибавлении 0,001 моль хлороводородной кислоты к 100 мл этого раствора его значение рН уменьшилось на DрН=0,09.
Ответ: 0,11.
. Рассчитайте значение рН 3%-го водного раствора пероксида водорода Н2О2. Плотность раствора принять равной 1 г/см3. Константа кислотной диссоциации пероксида водорода Ка=2,0∙10-12, рКа=1,70.
Ответ: 5,88.
. Рассчитайте значение рН буферной смеси, содержащей в 1 л раствора 0,10 моль гидрофосфата натрия Na2HPO4 и 0,30 моль дигидрофосфата натрия NaH2PO4. Константа диссоциации ортофосфорной кислоты по второй ступени равна Ка=6,2∙10-8, рКа=7,21.
Ответ: 6,73.
. Рассчитайте рН водного раствора метиламина CH3NH2 с концентрацией, равной 0,12 моль/л. Константа основности метиламина Кв=4,6∙10-3, рКв=3,34.
Ответ: 11,87.
. Рассчитайте степень гидролиза h и значение рН водного раствора нитрата аммония NH4NO3, содержащего 8,0∙10-3 г/мл этой соли. Константа основности аммиака Кв=1,76∙10-5, рКв=4,76.
Ответ: 7,6∙10-5; 5,14.
. Сколько граммов фосфата бария растворится в 100 мл 0,2 М раствора фосфата натрия?
. Будет ли образовывать осадок сульфата кальция, если к 0,1 М раствору хлорида кальция добавить равный объем 0,1 М раствора серной кислоты?
. Образуется ли осадок гидроксида железа (II), если к 20 мл 0,005 М раствора сульфата железа (II) прибавить 10 мл 0,5 М раствора аммиака?
. Рассчитать концентрацию ионов магния в растворе, если к 100 мл насыщенного раствора гидоксида магния добавлено 10 мл 0,5 М раствора гидроксида натрия.
. Рассчитать константу, степень гидролиза и рН 0,06 М раствора карбоната натрия. Что надо сделать, чтобы усилить гидролиз?
. При какой концентрации хромат-ионов начнется образование осадка хромата свинца из 0,08 М раствора нитрата свинца.
. К 25 мл 0,02 М раствора хлорида ртути (II) добавили 0,73 г хлорида натрия. Рассчитать равновесную концентрацию ионов ртути в растворе.
. При каком значении рН начнет выпадать осадок гидоксида магния из 0,02 М раствора хлорида магния?
. Рассчитать растворимость роданида серебра в 0,02 М растворе роданида аммония и сравнить с растворимостью этой соли в воде.
. Рассчитать молярную (моль/л) и массовую (г/л) растворимость хлорида серебра в 0,15 М растворе хлорида калия.
. В насыщенном растворе иодида свинца концентрацию иодид-ионов увеличили в 10 раз. Рассчитать концентрацию ионов свинца в полученном растворе.
. Образуется ли осадок гидроксида кадмия в растворе, содержащем 0,0015 моль/л хлорида кадмия и 5∙10-5 моль/л гидроксида натрия.
. В 1 л воды растворяется 0,04892 г иодата серебра. Рассчитать ПР иодата серебра.
. Рассчитать константу гидролиза, степень гидролиза, рН в 0,3 М растворе сульфита натрия. Выведите расчетные формулы.
. Рассчитать константу гидролиза, степень гидролиза и рН 0,2 М раствора формиата натрия. Выведите формулы для расчета.
. Рассчитать для 0,1 М раствора бензоата натрия константу гидролиза, рН и степень гидролиза.
. Раствор содержит 0,056 моль/л гидроксида аммония и 0,1 моль/л хлорида аммония. Рассчитать рН раствора. Как изменится рН, если 1 л этого раствора прибавить 0,001 моль гидроксида натрия.
. Сколько граммов бромида калия необходимо добавить к 100 мл 0,002 М раствора [Ag(NH3)2]+, в котором равновесная концентрация аммиака равна 0,5 моль/л, чтобы образовался осадок бромида серебра.
. Рассчитать равновесную концентрацию ионов меди в 0,01 М растворе [Cu(CNS)4]2-, содержащего избыток роданид-ионов 1 моль/л.
. Рассчитать равновесную концентрацию ионов серебра в растворе, содержащем 0,001 моль/л нитрата серебра и 0,102 моль/л цианида калия.
. При какой концентрации гидроксид-ионов будет образовываться осадок гидроксида меди (II) из 0,001 М раствора [Cu(NH3)4]2+?
. Написать уравнения диссоциации комплексных ионов и рассчитать равновесную концентрацию ионов цинка в 0,01 М растворе [Zn(NH3)4]2+ и в 0,1 М растворе [Zn(CN)4]2+. В каком растворе концентрация ионов цинка больше?
. Рассчитать константу гидролиза, степень гидролиза и рН 0,075 М раствора цианида калия.
. Рассчитать константу гидролиза, степень гидролиза и рН 0,05 М раствора ацетата натрия. Вывести формулы для расчета.
. Рассчитать константу гидролиза, степень гидролиза и рН 0,15 М раствора ацетата аммония. Выведите формулы для расчета.
. К 20 мл 0,1 М раствора уксусной кислоты добавили 40 мл 0,05 М раствора гидроксида аммония. Рассчитать рН полученного раствора.
. Рассчитать равновесную концентрацию ионов висмута в растворе комплекса [BiJ6]3- с концентрацией 0,1 моль/л, содержащем иодид калия с концентрацией 0,1 моль/л.
. При какой концентрации гидроксид-ионов будет образовываться осадок гидоксида кадмия в 0,005 М растворе [Cd(NH3)4]2+, если равновесная концентрация аммиака равна 0,1 моль/л.
. Смешаны равные объемы 0,02 М раствора нитрата серебра и 0,04 М растворе аммиака. Рассчитать равновесную концентрацию ионов серебра в полученном растворе.
. Будет ли образовываться осадок иодида серебра при добавлении твердого иодида калия до концентрации 0,25 моль/л к 0,002 М раствору цианидного комплекса серебра [Ag(CN)2]-, если равновесная концентрация цианид-иона 0,01 моль/л.
. Рассчитать равновесную концентрацию ионов никеля, если к 0,02 М раствору сульфата никеля добавить равный объем 3 М раствора аммиака. Считать, что в растворе образуются ионы [Ni(NH3)6]2+.
. Будет ли выпадать осадок сульфида ртути (II), если к 0,01 М раствору [HgJ4]2-, в котором равновесная концентрация иодид-ионов равна 1 моль/л, добавить 0,1 моль/л сульфида натрия.
. Рассчитать рН раствора, содержащего 0,015 моль/л гидроксида натрия и 0,01 моль/л хлорида аммония. Как изменится рН этого раствора, если к 1 л его прибавить 0,001 моль гидроксида натрия.
. Рассчитать рН раствора, полученного при добавлении к 500 мл 0,1 М раствора хлороводородной кислоты 8,2 г кристаллического ацетата натрия.
. К 0,5 М раствору уксусной кислоты добавлена хлороводородная до рН=0,5. Рассчитать степень диссоциации уксусной кислоты и концентрацию ацетат-ионов в полученном растворе.
. Какова должна быть концентрация ацетата натрия в растворе, содержащем 2 моль/л уксусной кислоты, чтобы рН этого раствора был равен 4.
. Как изменится рН при добавлении к 1 л буферной смеси, состоящей из 0,2 М раствора ацетата натрия и 0,2 М раствора уксусной кислоты, а) 0,02 моль хлороводородной кислоты, б) 0,02 моль гидроксида натрия, в) при разбавлении водой в 100 раз.
. Рассчитать концентрацию ионов водорода, рН, степень диссоциации в растворе: а) 0,2 М уксусной кислоты, б) 0,2 М уксусной кислоты в присутствии 1 M ацетата натрия.
. Смешаны равные объемы 0,4 М раствора гидроксида аммония и 0,4 М раствора нитрата аммония. Рассчитать рН этого раствора. Как изменится рН раствора после добавления к нему 0,05 моль/л хлороводородной кислоты.
. К 50 мл 0,4 М раствора гидроксида аммония добавили 50 мл 0,6 М растворе нитрата аммония. Рассчитать рН раствора и степень диссоциации гидроксида аммония.
. Сколько грамм формиата калия нужно прибавить к 1 литру 2 М раствора муравьиной кислоты, чтобы получилась буферная смесь с рН равным 2.
. Во сколько раз уменьшится концентрация ионов серебра в 0,1 М растворе комплекса [Ag(CN)2]-, если к этому раствору добавить цианид калия до концентрации 0,1 моль/л.
. Раствор 0,05 н. муравьиной кислоты нейтрализован 0,05 н. раствором гидроксида калия на 90%. Рассчитать pH полученного раствора.
. Рассчитать рН буферного раствора, полученного при сливании 1 л 0,5 М раствора гидроксида аммония и 1 л 0,5 М раствора хлорида аммония. Как изменится рН раствора при добавлении 5 мл 0,5 М хлороводородной кислоты к 50 мл буферной смеси?
. Буферный раствор содержит 0,5 моль/л уксусной кислоты и 0,25 моль/л ацетата натрия. Рассчитать рН раствора. Как изменится рН при добавлении к 1 литру этого раствора 0,25 моль хлороводородной кислоты?
. Рассчитать рН в растворе, полученном при сливании 40 мл 0,05 М раствора уксусной кислоты и 20 мл 0,1 М раствора гидроксида калия. Какова степень гидролиза полученного раствора соли? Чему равен pH раствора?
. Образуется ли осадок сульфата свинца, если к 0,002 М раствору нитрата свинца, содержащему 1 моль/л ацетата натрия, добавить 0,1 моль/л сульфата натрия? В указанных условиях существует комплекс состава [Pb(CH3COO)4]2-.
. Рассчитать значение рН раствора, полученного при сливании 40 мл 0,2 М раствора уксусной кислоты и 20 мл 0,1 М раствора гидроксида натрия.
. Как изменится рН 0,1 М формиатной буферной смеси при добавлении к 1 л этого раствора: а) 0,05 моль HCl, б) 0,05 моль КОН?
. Какова должна быть концентрация хлорида аммония в растворе, содержащем 0,5 моль/л аммиака, чтобы концентрация гидроксид-ионов стала 0,0005 моль/л? Концентрацию хлорида аммония выразите в моль/л и г/л.
. Чему равна степень ионизации муравьиной кислоты в 0,05 н. растворе, если известно, что концентрация Н+ в нем равняется 0,01 моль/л?
Ответ: a=0,02 (2%).
. Подсчитать, во сколько раз меньше растворимость AgCl (ПРa=1,78∙10-10) в 0,01 н. растворе NaCl по сравнению с его растворимостью в чистой воде.
Ответ: ≈ в 730 раз.
. При каком рН начинается осаждение гидроксида алюминия из 0,1 М раствора его соли? Ответ: при рН=3,7.
. Чему равны активности Са2+ и Cl- -ионов в 0,02 н. растворе CaCl2?
Ответ: aСа2+ = 0,0054; aCl- = 0,0172.
. Найти концентрацию H+ и HS- -ионов в 0,1 М растворе H2S.
Ответ: [H+]=[HS-]=9,4∙10-5 моль/л.
. Растворимость Fe(OH)3 равна 2∙10-8 г/л. Определите ПРFe(OH)з.
Ответ: ПРFe(OH)з=3,2∙10-38.
. Рассчитайте ионную силу раствора, образовавшегося через некоторое время после смешивания 0,5 л раствора натрия сульфата Na2SO4 с концентрацией с(Na2SO4)=0,02 моль/л и 0,5 л раствора бария хлорида BaCl2 с концентрацией c(BaCl2)=0,02 моль/л.
Ответ: 0,02.
. Рассчитайте концентрацию ионов гидроксония Н3О+ для водного раствора при рН=4,32. Ответ:4,79∙10-5 моль/л.
. Рассчитайте рН водного 0,36%-го раствора хлороводородной кислоты HCl. Плотность раствора принять равной единице.
Ответ: 1,09.
. Как изменится значение рН 1 л исходного водного раствора хлороводородной кислоты при прибавлении к нему 0,1 моль гидроксида натрия. Концентрация исходного раствора с(HCl)=0,01 моль/л. Изменением объема раствора пренебречь.
Ответ: значение рН раствора увеличится от 2,04 до 12,84.
. Рассчитайте буферную емкость b ацетатного буфера, если известно, что при прибавлении 1∙10-3 моль хлороводородной кислоты к 1 л этого буферного раствора его значение рН понизилось на 0,087.
Ответ: 1,15∙10-2 моль кислоты.
. Определите, какой объем водного 0,30 моль/л раствора аммиака потребуется для растворения 66,4 мг хромата серебра (I) Ag2CrO4 по реакции: Ag2CrO4+4NH3→[Ag(NH3)2]2CrO4.
Ответ: 2,67 мл.
. Рассчитайте рН водного 0,33-%го раствора азотной кислоты HNO3. Плотность раствора принять равной единице.
Ответ: 1,35.
. Покажите, во сколько раз уменьшится равновесная концентрация ионов серебра (I) в 0,10 моль/л растворе комплекса K[Ag(CN)2], если к этому раствору прибавить цианид калия KCN до концентрации с(KCN)=0,1 моль/л. Полная константа нестойкости комплексного аниона [Ag(CN)2]- = 10-20,55.
Ответ: уменьшится в 1,5∙1013 раз.
. Рассчитайте равновесную концентрацию ионов висмута (III) в растворе комплекса K3[BiJ6] с концентрацией 0,1 моль/л, содержащем иодид калия KJ с концентрацией 0,1 моль/л. Полная константа нестойкости комплексного аниона равна 10-19,1.
Ответ: [Bi3+]=7,9∙10-15 моль/л.
Дата публикования: 2014-11-18; Прочитано: 8719 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
