 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретические основы раздела
|
|
Все тела могут обмениваться с окружающей средой молекулами, ионами, радикалами и т.п. частицами. Тело, на поверхности которого названные частицы приобретают или теряют электроны, называют электродом, а окислительно-восстановительный процесс, протекающий на его поверхности, называется электрохимической реакцией. Так, на поверхности раздела фаз «металл – раствор» возникает скачок потенциала или электродный потенциал Е. Величина электродного потенциала Е выражается уравнением Нернста:
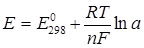 , (4.1)
, (4.1)
где а – активность ионов в растворе;
Е0298 – стандартный потенциал электрода;
R – универсальная газовая постоянная, 8,314 Дж/моль К;
Т – абсолютная температура, К;
F – число Фарадея, 96500 Кл;
n – число электронов электродной реакции.
Если в уравнение (4.1) подставить постоянные R и F, а от натурального логарифма перейти к десятичному, то получим:
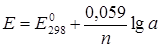 . (4.2)
. (4.2)
Абсолютную величину скачка потенциала определить не представляется возможным, поэтому стандартные электродные потенциалы измеряются по отношению к потенциалу нормального водородного электрода. Последний представляет собой платиновый электрод, погруженный в раствор серной кислоты с активностью ионов водорода, равной 1 моль/л. Через этот раствор под давлением в 1 атм. и при температуре 298 К (250С) пропускается газообразный водород. В системе устанавливается равновесие между ионами водорода кислоты и молекулами водорода: Н2 = 2Н+ + 2ē.
По международному соглашению потенциал нормального водородного электрода принят равным 0.
Для определения значения стандартного потенциала металла составляют гальваническую цепь, одним из электродов которой является нормальный водородный электрод. Тогда знак стандартного электродного потенциала соответствует знаку заряда, который электрод приобретает в этой цепи. Если металл посылает электроны в такой цепи к нормальному водородному электроду (т.е. является восстановителем), то величина стандартного электродного потенциала его выражают знаком «-»; если электрод из металла получает электроны от водородного электрода (т.е. является окислителем), то величину стандартного потенциала электрода из металла выражают знаком «+». По значению стандартных электродных потенциалов Е0298 все металлы располагаются в ряд напряжения металлов.
Все электроды можно классифицировать на следующие группы.
Электроды первого рода представляют собой металлы или неметаллы, опущенные в раствор электролита, содержащего одноименные ионы, по отношению к которым электрод обратим. Условно такой электрод записывается так: Меn+/Ме. Тогда электродная реакция будет иметь вид: Меn+ + nē = Ме.
Потенциал такого электрода равен:
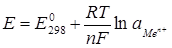 , (4.3)
, (4.3)
где 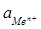 - активность катиона металла в растворе.
- активность катиона металла в растворе.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли и погруженного в раствор, содержащий тот же анион, что и труднорастворимая соль. Схематически такой электрод представляют: Anˉ/MeAn, Me. Электродная реакция имеет вид: МеAn + nē = Me + Anˉ.
Потенциал электрода второго рода равен:
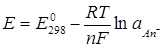 , (4.4)
, (4.4)
где  - активность аниона в растворе.
- активность аниона в растворе.
Такие электроды часто применяют в качестве электродов сравнения, так как их потенциалы легко воспроизводимы и устойчивы. К ним относятся хлорсеребряные, каломельные, ртутно-сульфатные электроды.
Наибольшее распространение получил хлорсеребряный электрод. Он представляет собой серебряную проволоку, покрытую нерастворимым хлоридом серебра AgCl и опущенную в раствор хлорида калия KCl: Ag | AgCl | KCl.
Потенциал такого электрода зависит от активности иона хлора 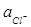 в растворах:
в растворах:
Е = 0,224 – 0,059 ∙ lg  (4.5)
(4.5)
Для электрода, погруженного в насыщенный раствор КCl при 250С (298 К), потенциал равен +0,197 В.
Газовые электроды представляют собой электроды, состоящие из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Потенциал газовых электродов зависит от активности ионов этого газа и от парциального давления газа. Примером газового электрода является нормальный водородный электрод.
Окислительно-восстановительные электроды, редокс-электроды. Простые редокс-электроды представляют собой платиновую проволоку, опущенную в раствор, содержащий ионы элемента в разных степенях окисления, т.е. в окисленном и восстановленном состоянии. Электрод инертный, сам не принимает участие в окислительно-восстановительном процессе. Тогда электродная реакция сводится к перемене степени окисления ионов без перемены их состава.
Например, для электрода Pt | Fe3+, Fe2+ электродная реакция имеет вид: Fe3+ + ē = Fe2+.
Электродный потенциал такого электрода рассчитывается по следующему уравнению:
 , (4.6)
, (4.6)
где аОх, аRed – активности окисленной и восстановленной форм ионов соответственно.
На ряде редокс-электродов реакция протекает не только с изменением степени окисления реагирующих частиц, но их состава, т.к. в реакции принимают участие и частицы среды: ионы Н+ или молекулы Н2О.
Схема сложных редокс-электродов может быть представлена следующим образом: Red, Ox, H+ | Pt.
Тогда очевидно, что потенциал сложного редокс-электрода будет зависеть не только от активностей окисленной и восстановленной форм, но и активности ионов частиц среды. Например, для системы «хинон – гидрохинон» с реакцией С6Н4О2 + 2Н+ + 2ē = С6Н4(ОН)2 потенциал электрода равен:
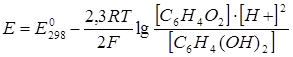 . (4.7)
. (4.7)
Последняя зависимость показывает, что потенциал хингидронного электрода зависит от рН среды, что можно выразить формулой:
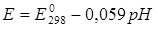 , (4.8)
, (4.8)
где Е0298 = 0,699 В. Используя эту зависимость можно рассчитать рН среды.
Ионоселективные электроды отличаются от рассмотренных тем, что в электродной реакции не принимают участие электроны. Электродная реакция сводится к обмену ионами между электродом и раствором. Чувствительным элементом таких электродов является мембрана – твердая или жидкая. Ионоселективные электроды разделяют на следующие группы: стеклянные, твердые, жидкие и газовые.
Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их возможные комбинации. Различают два основных типа электрохимических систем, называемых электрохимическими цепями – химические и концентрационные.
Электродвижущая сила цепи является величиной положительной, так как она соответствует самопроизвольному процессу, дающему положительную работу. ЭДС любой цепи равна разности потенциалов отдельных электродов, т.е. алгебраической сумме положительных и отрицательных величин.
Электродвижущая сила химического гальванического элемента в общем случае рассчитывается по формуле:
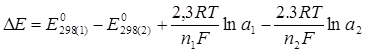 , (4.9)
, (4.9)
где Е0298(1) – стандартный потенциал катода;
Е0298(2) – стандартный потенциал анода;
а1 – активность ионов в катодном пространстве;
а2 – активность ионов в анодном пространстве.
При n1 = n2 формула приобретает вид:
 . (4.10)
. (4.10)
Если n1 = n2 и а1 = а2, то:
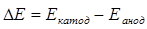 . (4.11)
. (4.11)
Концентрационные цепи представляют собой два одинаковых электрода, погруженных в растворы одного и того же электролита различной концентрации. Анодом является электрод, погруженный в раствор меньшей концентрации, и на нем происходит процесс окисления. Электродвижущая сила концентрационного элемента рассчитывается по уравнению:
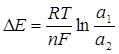 , где а1 > а2. (4.12)
, где а1 > а2. (4.12)
При стандартной температуре:
 . (4.13)
. (4.13)
Поскольку величина ЭДС концентрационной цепи невелика, они не используются для получения электрического тока, а применяются для определения концентрации исследуемых растворов.
Если гальванический элемент работает термодинамически обратимо, то при этом совершается максимальная полезная работа, равная:
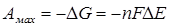 , (4.14)
, (4.14)
где ∆Е – электродвижущая сила цепи.
Изменение энтропии реакции, происходящей в гальваническом элементе, можно рассчитать, пользуясь соотношением:
 , тогда
, тогда 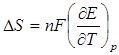 , (4.15)
, (4.15)
где 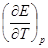 – температурный коэффициент гальванического элемента, который
– температурный коэффициент гальванического элемента, который
показывает, на сколько вольт изменяется электродвижущая сила цепи при изменении температуры на 1 градус.
Величину энтальпии реакции получаем, применив уравнение Гиббса-Гельмгольца:
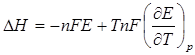 . (4.16)
. (4.16)
Типовые расчеты
Пример 1
ЭДС элемента Cu|Cu2+ (а = х моль/л) || Cu2+|Cu (а = 1 моль/л) равна 0,0885 В при 250С. Определить х.
Решение.
Представленный элемент относится к концентрационным цепям, поэтому расчет производится по уравнению:
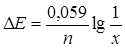 ,
,  .
.
Отсюда находим х = 0,001. Активность ионов меди в анодном пространстве равна 0,001 моль/л.
Пример 2
Определить константу равновесия реакции, протекающей в элементе: Zn|Zn 2+ (а = 1 моль/л) || Cu 2+ (а = 1 моль/л)|Cu.
Решение.
Константа равновесия вычисляется по уравнению: ∆G0298 = 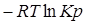 .
.
Изменение свободной энергии связано с ЭДС элемента уравнением:
∆G0298 =  . Откуда находим:
. Откуда находим: 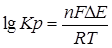 .
.
Находим ЭДС ∆Е = 0,34 – (-0,76) = 1,1 В, следовательно,
lgКр = 37,295, тогда Кр = 1,972∙1037.
Пример 3
Разобрать работу гальванического элемента
Cd|Cd 2+ (а = 0.125 моль/л) || Zn 2+ (а = 0.001 моль/л)|Zn:
а) вычислить ЭДС;
б) написать уравнения электродных процессов;
в) определить направление тока во внешней цепи;
г) вычислить ∆G.
Решение.
В таблице приложения находим значения стандартных электродных потенциалов: Е0298 Zn|Zn2+ = -0,76 В; Е0298 Сd|Cd2+ = -0,40 В.
Цинковый электрод в данной цепи будет анодом, а кадмиевый – катодом. Электроны во внешней цепи перемещаются от цинкового электрода к кадмиевому.
На цинковом электроде идет реакция окисления: Zn0 - 2ē = Zn2+, на кадмиевом – реакция восстановления: Cd2+ + 2ē = Cd0. Суммарная реакция за счет которой работает гальванический элемент: Zn0 + Cd2+ = Zn2+ + Cd0.
ЭДС вычисляется по уравнению (4.9):
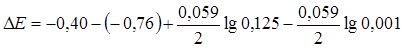 = 0,3603 В.
= 0,3603 В.
Изменение свободной энергии Гиббса рассчитываем по уравнению:
∆G0298 =  = -296500 ∙ 0,3603 = -69,54 кДж/моль.
= -296500 ∙ 0,3603 = -69,54 кДж/моль.
Многовариантная задача
Составить электрохимическую цепь из предложенных электродов и рассмотреть для стандартных условий его работу:
а) указать анод, катод и определить знаки электродов;
б) написать уравнения электродных процессов;
в) определить направление движения электронов во внешней цепи;
г) рассчитать ЭДС элемента;
д) рассчитать термодинамические характеристики реакции, протекающей в гальваническом элементе.
Дата публикования: 2014-11-18; Прочитано: 1232 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
