 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Umwandlung elektrischer Energie in chemische Energie
|
|
Zur Abscheidung von Stoffen durch Ionentransport an den Elektroden wird elektrische Energie benötigt. Man bezeichnet diesen Vorgang als Elektrolyse. Diese Umwandlung elektrischer Energie in chemische Energie dient verschiedenen Zwecken.
In der Elektrometallurgie erhält man auf diese Weise Metalle (Cu, Al, Zn usw.) in chemisch nahezu reiner Form. Bei der Kupfergewinnung wird als Elektrolyt Kupfersulfat, als Katode dünnes Reinkupferblech und als Anode Rohkupfer verwendet. Das Rohkupfer geht in Ionenform in Lösung und schlägt sich an der Katode nieder. Aluminium wird durch Schmelzelektrolyse gewonnen, wobei der Tonerde (A12O3) Kryolith (Na3AlF6) zur Herabsetzung des Schmelzpunktes beigegeben wird. Zur Aufrechterhaltung der Temperatur (etwa 950°C) dient die durch den Widerstand des Elektrolyten entstehende Stromwärme.
In der Galvanostegie werden unedle Metalle mit edleren überzogen (Vergolden, Verchromen, Vernickeln usw.).
Die Galvanoplastik stellt Abdrucke (Klischees) von Körpern her, wobei diese, wenn es Nichtleiter sind, zuvor mit einer leitenden Schicht überzogen werden müssen.
Text 5
Umwandlung chemischer Energie in elektrische Energie Galvanisch Elemente (Primärelemente)
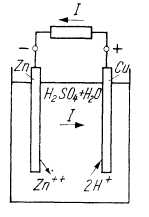
Werden zwei Elektroden aus verschiedenem Metall in einen Elektrolyten getaucht, so bildet sich auf Grund des unterschiedlichen Lösungsdruckes der Metalle zwischen beiden eine Spannung aus, die durch einen außen angeschlossenen Widerstand einen Strom zu treiben vermag. Steckt man beispielsweise einen Kupferstab und einen Zinkstab in verdünnte Schwefelsäure, so hat das Zink als das unedlere Metall den höheren Lösungsdruck. Es wird gegenüber dem Kupfer negativ. Der Strom im äußeren Kreis fließt vom Kupfer zum Zink. In diesem von Volta angegebenen Element bilden die Zinkionen mit dem Schwefelsäurerest Zinksulfat (Bild 1), während die Wasserstoffionen zum Kupfer wandern. Die Zinkelektrode wird also aufgelöst, und es bildet sich Zinksulfat im Elektrolyten. Der Wasserstoff an der Kupferelektrode führt zur Ausbildung einer Polarisationsspannung, die die an den Klemmen wirksame Spannung vermindert.
| Bild 1. Volta-Element |
 Um die Polarisation zu vermeiden, gibt es verschiedene Möglichkeiten. Im Daniell-Element verwendet man ebenfalls Kupfer und Zink als Elektroden, trennt aber beide durch eine halbdurchlässige Wand (Diaphragma). An der Kupferelektrode ist der Elektrolyt Kupfersulfat CuS04 anstelle von Schwefelsäure. Das Diaphragma ist durchlässig für H+-Ionen, verhindert aber eine Durchmischung der zwei unterschiedlichen Elektrolyte.
Um die Polarisation zu vermeiden, gibt es verschiedene Möglichkeiten. Im Daniell-Element verwendet man ebenfalls Kupfer und Zink als Elektroden, trennt aber beide durch eine halbdurchlässige Wand (Diaphragma). An der Kupferelektrode ist der Elektrolyt Kupfersulfat CuS04 anstelle von Schwefelsäure. Das Diaphragma ist durchlässig für H+-Ionen, verhindert aber eine Durchmischung der zwei unterschiedlichen Elektrolyte.
Text 6
Дата публикования: 2014-11-02; Прочитано: 670 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
