 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Идеал газ
|
|
Физикалық моделі мынадай:
1) Газ молекулаларының көлемі ыдыс көлемімен салыстырғанда аз болады.
2) Газ арасында молекулалары күштік әсер болмайды.
3) Газ молекулаларының өзара және ыдыс қабырғасымен соқтығысуы абсолютті серпімді болады.
Бұдан шығатын қорытынды:
Идеал газдарды көлемі көзге ілінбейтін және қашықтықта бір – бірімен
әрекеттеспейтін тәртіпсіз қозғалыстағы молекула – шариктердің жиынтығы деп қарастыруға болады.
Идеал газ әрекеттерін сипаттайтын заңдар: Бойль –Мариотт, Авогадро, Дальтон, Гей – Люссак заңдары.
4. Бойль – Мариотт заңы
Тұрақты температурада Т, берілген m масса (газдың) үшін,V көлем мен P қысымның көбейтіндісі - тұрақты шама.
PV = const егер T = const және m = const болса.
Тұрақты температурадағы заттың қасиетін сипаттайтын, P және V арасындағы байланысты көрсететін қисық изотерма деп аталады. Изотерма – болған процестің температурасы жоғары болған сайын графикте де жоғары орналасатын гипербола.
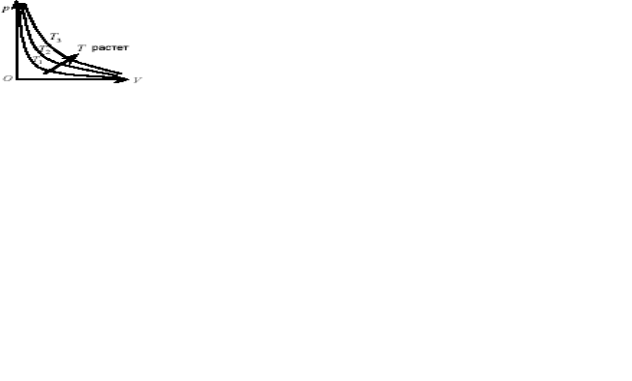
5. Авогадро заңы.
Заттың мөлшері ν – физикалық шама, ол cпецификациялық элемент құрылымы сандарымен анықталады. Олар – молекула, атом немесе бір заттың құрамындағы ион.
Зат мөлшерінің бірлігі – моль – 0,012кг 12С көміртегі изотопындағы құрылым элемент қанша болса, соншадан тұратын жүйе затының мөлшері.
Әртүрлі заттардың бір молінде NА молекула саны бірдей болады, ол Авогадро саны деп аталады.
NA = 6.022*1023 1/ моль
Авогадро заңы: Әртүрлі заттардың молі бірдей температурада және қысымда бірдей көлемде болады. Температурасымен қысымы бірдей кез – келген газдың мольдерінің көлемдері де бірдей болады.
T = T0, P = P0 шарттарында Vµ көлемі (мольдік көлем) мынаған тең:
Vµ = 22.41*10-3 м3/моль
Мольдік масса µ = m/ν, бұл заттың бір молінің массасы. Бұдан ν = m/µ
Мольдік массаның бірлігі – кг/ моль
6. Дальтон заңы.
Парциалдық қысым дегеніміз – ол құрама газ құрамына кіретін газдың, егер ол, сол температурада құрама газдың көлемін толық алған жағдайда газдың түсіретін қысымы.
Дальтон заңы: Құрама идеал газ қысымы оған кіретін газдардың парциальдық қысымдар p1, p2,…, pn – лардың қосындысына тең;
P= p1+p2+…+pn немесе P= 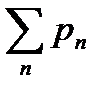
7. Гей- Люссак заңы.
1) тұрақты көлемде берілген массасы m газ қысымы p t температурасы бойынша түзу сызық бойымен өзгереді:
Р= р0 (1+at), егер V= const, m= const болса
2) Тұрақты қысымда берілген массасы m газ көлемі V t температурасы бойынша түзу сызық бойымен өзгереді:
V = V 0 (1+at), егер Р = const, m= const,
мұндағы, a= 1/273К-1,V 0 және Р0 - t=0 0C – ғы қысым мен көлем.
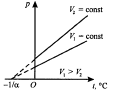
Тұрақты қысымда өтетін процесс изобаралық деп аталады. (V, t) координатасының диаграммасында бұл процесс изобара деп
аталатын түзумен сипатталады.
Тұрақты көлемде өтетін процесс изохоралық деп аталады. (Р, t) координатасының диаграммасында бұл процесс изохора деп аталатын түзумен сипатталады.
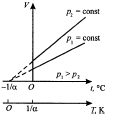
Температура осі t = - 1/a =-2730C нүктесінде изобара мен изохора қиылысады. Егер нәтиженің басын осы нүктеге қойсақ, онда Кельвин шкаласын (термодинамикалық температура) аламыз: T= t + 1/a
Температураның термодинамикалық шкаласында
V = V0 (1+αt) = V0αT, P = P0(1+αt) = P0αT
Бұдан V1/V2 = T1/T2 немесе V/T = const егер p=const; m= const
P1/P2 = T1/T2 немесе P/T = const егер v=const; m= const (Шарль заңы). Мұндағы 1 және 2 индекстері изобара немесе изохорада жатқан кез-келген туынды күйлер.
8. Идеал газ күйінің теңдеуі.
Термодинамикалық системаның күй теңдеуі деп - термодинамикалық тепе – теңдікте тұрған жүйедегі қысым P, көлем V және температура T – ны байланыстыратын теңдеуді атаймыз:
f = (P,V, T) = 0
мұндағылардың біреуі келесі екеуінің функциясы
Газдың біраз массасы көлем V1, қысым P1 – де болсын және T1 температурада болсын. Бұл газ массасы басқа туынды күйде P2,V2,T2 параметрлерімен сипатталсын. 1 – ші жағдайдан 2 – ші жағдайға өту изотермиялық (1-1′) және изохоралық (1′ - 2) процестер арқылы жүзеге асады.
Бойль – Мариотт және Гей – Люссак заңдарынан:
P1V1 = p1V2; p1/P2 = T1/ T2
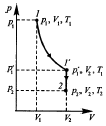
P1 – ді алып тастап, и деал газдың күй теңдеу»н аламыз:
P1V1/ T1 = P2V2/ T2 немесе PV/ T = const
Авогадро заңы бойынша, p және T бірдей болған жағдайда барлық газдардың молі бірдей молярлы көлемде Vµ болады.
Идеал газдың молінің күй теңдеуі мынадай:
pVµ=RT, мұндағы R=8.31 Дж/(моль·К) – универсалды газ тұрақтысы
Көлемі газ массасы m: V = ν Vµ = m/ M ·Vµ
Бұдан, pV = m/M *p Vµ = m/M * RT = νRT
Менделеев – Клапейрон теңдеуі –массасы m идеал газдың күй теңдеуі
pV=m / M·R
Егер Больцман тұрақтысын пайдалансақ:
К=  онда күй теңдеуі мына түрге келеді: Р=
онда күй теңдеуі мына түрге келеді: Р= 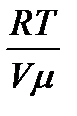 =
= 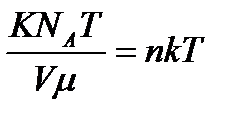
Көлем бірлігіндегі молекулалар саны: 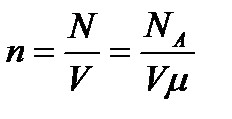 - молекулалар концентрациясы.
- молекулалар концентрациясы.
Сонымен:
1) Берілген температурада идел газдың қысымы молекулаларының концентрациясына тура пропорционал.
2)Температура мен қысымы бірдей барлық газдардың бірлік көлеміндегі молекулалардың саны бірдей. Қалыпты жағдайдағы 1м3-дегі молекуланың санын Лошмид саны деп атайды.

9. Идеал газдардың молекулалық – кинетикалық
теориясындағы негізгі теңдеу
Көлемі V ыдыста жалпы массасы m,жылдамдығы бірдей υ, массасы m0, N молекуладан тұратын идеал газ болсын.
n=N\V газдағы молекулалар концентрацияциясы (анықтама бойынша)
Егер элементар ауданы 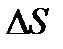 тең қабырғамен
тең қабырғамен 
 соғысу уақытысында
соғысу уақытысында 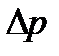 импульс берілсе, онда ыдыстың қабырғасына түсірілген газ қысымы P=
импульс берілсе, онда ыдыстың қабырғасына түсірілген газ қысымы P= 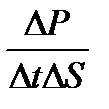 тең. Әрбір соқтығыс кезінде қабырғаға перпендикуляр қозғалатын молекула оған 2 m0υ импульс береді. Жалпы алғанда қабырғаға қарай барлық молекуланың 1\6 бөлігі қозғалады. Енді бір-біріне перпендикуляр 3 осьті қарастырайық, онда әр осьтің бойымен жалпы алғанда молекуланың 1\3 бөлігі қозғалады, және олардың тек 1\2 (1\3)-тің жартысы ғана берілген бағытта қозғалады. Сондықтан
тең. Әрбір соқтығыс кезінде қабырғаға перпендикуляр қозғалатын молекула оған 2 m0υ импульс береді. Жалпы алғанда қабырғаға қарай барлық молекуланың 1\6 бөлігі қозғалады. Енді бір-біріне перпендикуляр 3 осьті қарастырайық, онда әр осьтің бойымен жалпы алғанда молекуланың 1\3 бөлігі қозғалады, және олардың тек 1\2 (1\3)-тің жартысы ғана берілген бағытта қозғалады. Сондықтан  уақытында
уақытында 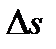 ауданға
ауданға  молекула жетеді, және оған
молекула жетеді, және оған  импульс береді. Ыдыстың қабырғасындағы газ қысымы P=
импульс береді. Ыдыстың қабырғасындағы газ қысымы P= 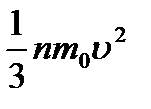 ;
;
Егер V көлемдегі молекулалар саны N болса және олардың жылдамдығы: υ1, υ2,...... υn болса онда орташа квадрат жылдамдық <υкв2> арқылы анықталады және барлық газ молекулаларының жиынтығын сипаттайды.
N vmax
<υкв2> = 1/n N ∑ υ i2 = 1/ N ∫ υ2 dNυ
i=1 0
Идеал газдардың молекулалық-кинетикалық теориясының негізгі теңдеуі
P= 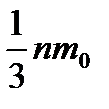
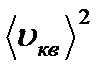 pV=
pV= 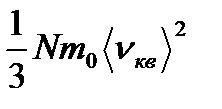
n =N/V және m =N  қатынасын pV=
қатынасын pV= 
ескере отырып бұл теңдеудің басқа pV=
басқа варианттарын келтіруге болады. рV = 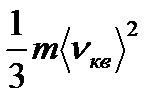 Мұндағы Е -барлық газдардың жылжымалы pVm=
Мұндағы Е -барлық газдардың жылжымалы pVm= 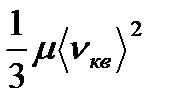 қозғалыстағы кинетикалық энергияның
қозғалыстағы кинетикалық энергияның
қосындысы.
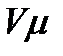 -мольдік көлем
-мольдік көлем
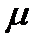 -мольдік масса.
-мольдік масса.
Kлапейрон-Менделеев теңдеуін рVµ = 
пайдалансақ: RT= 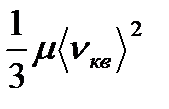 , бұдан
, бұдан
10. Идеал газ молекулаларының орташа квадраттық жылдамдығы:
á 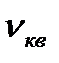 ñ=
ñ= 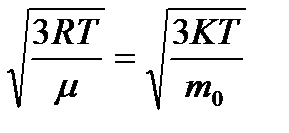 мұндағы, m = m
мұндағы, m = m  және k=R/N
және k=R/N 
Идеал газдың бір молекуласының жылжымалы қозғалысының орташа кинетикалық энергиясы:
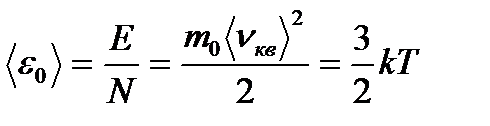
Бұдан 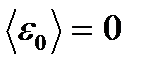 , егер Т=О К – ге тең болса, онда газ молекулаларының қозғалысы тоқтайды деген қорытынды шығады.
, егер Т=О К – ге тең болса, онда газ молекулаларының қозғалысы тоқтайды деген қорытынды шығады.
Температураны молекула-кинетикалық тұрғыдан түсіндіру:
Термодинамикалық температура - газ молекулаларының жылжымалы қозғалысының орташа кинетикалық энергиясының өлшемі.
11. Идеал газ молекулаларының жылдамдығы бойынша
таралуы туралы Максвелл заңы.
Берілген температурда тепе-теңдік күйдегі газда уақыт бойынша өзгермейтін молекулалардың белгілі бір қалыпты жылдамдықтарының таралуы орын алады. Бұл таралу молекулалардың жылдамдығы бойынша таралу функциясы деп аталатын f`(u) функциясымен сипатталады. Ол жылдамдығы u мен u+du аралығында жататын молекулалардың салыстырмалы санын анықтайды.
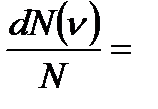 f(u)du,
f(u)du,
Максвелл заңы: f(u)=4p 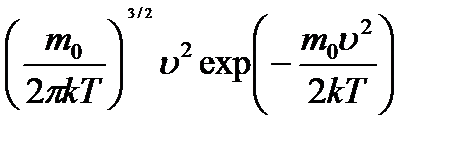
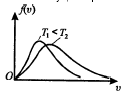
Бұл функция òf(u)du = 1 нормальды шартты қанағаттандырады.
Идеал газ молекулаларының ең ықтимал жылдамдығы:
Идеал газ молекуласының жылдамдық бойынша таралу функциясы максимал мәнге ие болатын жылдамдық ең ықтимал жылдамдық деп аталады.
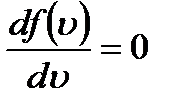 теңесек u
теңесек u 
Температура ұлғайған сайын uв өседі.
12. Газ молекуласының орташа жылдамдығы (орташа арифметикалық жылдамдық):
áuñ= 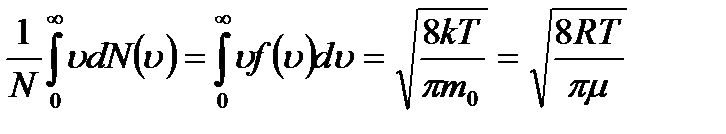
14. Газ күйін сипаттайтын жылдамдықтар.
| Ең ықтимал жылдамдық | Орташа жылдамдық | Орташа квадраттық жылдамдық |
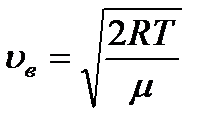
| 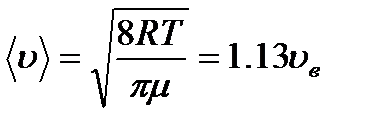
| 
|
15. Барометрлік формула.
Жердің бір келкі тартылу өрісінде молекулалардың жылулық жылдамдығы газ күйінің қалыпты бір күйіне келеді, бұл кезде газдың қысымы биіктік өскен сайын кемиді. Мольдік массасы m газдың h биіктіктегі қысымы теңіз деңгейіндегі қысым P  -ге қатысты былай өзгереді:
-ге қатысты былай өзгереді:
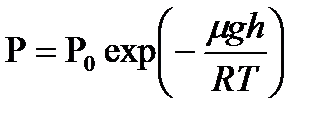
Дата публикования: 2015-10-09; Прочитано: 8669 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
