 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Диффузия
|
|
Диффузия - бір-біріне жанасқан кездегі 2 газдың, сұйықтың, тіпті қатты дененің бөлшектерінің өздігінен бір - біріне өтуі және араласуы. Диффузия таза газда газ көлеміндегі әртүрлі тығыздықтан, ал аралас газдарда олардың концентрациялық әртүрлілігінен болады.
Массаның тасымалдануында химиялық Jm = - D dp/dx; біртекті біртекті газдар үшін Фик заңы орындалады.
Jm- массаның ағын тығыздығы,
D - диффузия коэффициенті, 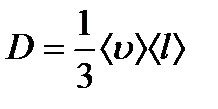
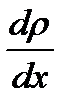 - тығыздық градиенті.
- тығыздық градиенті.
22. Ішкі үйкеліс (тұтқырлық).
Бұл газ қабатының арасындағы молекулалардың әртүрлі жылдамдықпен қозғалған кезіндегі пайда болатын құбылыс. Жылдамырақ қозғалған қабат жайырақ қозғалған қабатқа үдету күшімен әсер етеді және ол қабаттың кез келген молекуласының жылдамдығы артады. (Бірінші қабаттан басқа қабаттарда импульстың тасымалдануы пайда болады). Жылдамдықтары төмен қабат жылдамдықтары жоғары қабаттың жылдамдығын азайтады (тежейді), яғни үйкеліс күші әсер етеді де қабаттардың арасында үйкеліс күші пайда болады. Ол жанасқан қабаттар арқылы жүретін жанама болып бағытталады.
Ішкі үйкеліс Ньютон заңымен jp=- ŋ dv/dx;
сипатталынады:
jр- импульстың ағынының тығыздығы,
ŋ - динамикалық тұтқырлық 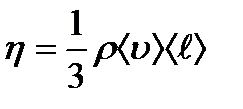
dv/dx - газ қабатының қозғалыс бағытына перпиндикуляр, ол x бағытында жылдамдықтың тез өзгеруін көрсетеді немесе жылдамдық градиенті деп аталынады.
Хаостық қозғалыс процесі кезінде молекулалардың араласу механизмінің құбылыстары үшін жалпылығы ішкі үйкеліс, диффузия, жылу өткізгіштік математикалық теңдеулердің сыртқы ұқсастығына әкелуі мүмкін.
λ, D, ŋ коэффициенттері арасындағы формулалар молекулалардың жылу қозғалысының сипаттамалық және тасымалдау коэффициенттері арқылы байланысады:
λ, D және ŋ арасындағы байланыс: ŋ=ρD λ/ŋCv=1
| Термодинамика негіздері |
23. Термодинамика жүйесіндегі ішкі энергия.
Ішкі энергия U - бұл жүйедегі микробөлшектердің хаосты (жылулық) қозғалысының және осы бөлшектердің (молекула, атом, электрон, ядро т.с.с) әсерлесу энергиясы. Ішкі энергияға жүйедегі кинетикалық энергия және сыртқы потенциалдық энергия жатпайды.
Ішкі энергия - термодинамикалық жүйе күйінің бір мәнді функциясы, ал әр жүйе толығымен ішкі энергиясымен анықталынады. Сондықтан ішкі энергия жүйенің қазіргі күйге қалай келгеніне тәуелді емес. Ішкі энергияның өзгерісі бір күйден 2-ші күйге өткенде тек қана осы күйлердің ішкі энергиясының өзгерісімен анықталынады және ауысу жолына тәуелді емес.
24. Еркіндік дәрежесінің саны.
Еркіндік дәрежесінің саны – кеңістіктегі жүйенің күйін толық анықтайтын, тәуелсіз айнымалылардың саны.
Қатты молекулалардың идеал газының еркіндік дәрежесінің саны.
| Еркіндік дәрежесінің саны. | Бір атомды газ | Екі атомды газ | Көп атомды газ |
|

|

| |
| Жылжымалы | |||
| Айналмалы | - | ||
| Барлығы |
Реалды молекулаларда атом мен молекулалардың арасында тығыз байланыс жоқ, сондықтан молекулалардың ішіндегі атомдардың тербелмелі қозғалысының еркіндік дәрежесін де есепке алу керек.
Молекулалардың жалпы еркіндік дәрежесінің санына байланыссыз, 3 еркіндік дәрежесі әрқашан жылжымалы. Олардың әрқайсысына молекулалардың жылжымалы қозғалысының кинетикалық энергиясын 1/3 береміз (e0).

25. Еркіндік дәрежесі бойынша энергияның бірқалыпты
таралуына арналған Больцман заңы.
Жүйе үшін термодинамикалық тепе-теңдікте болған жағдайда тура және айналмалы еркіндік дәрежелері үшін орташа кинетикалық энергия kТ/2-ге тең, ал әр тербеліс еркіндік дәрежесінің орташа энергиясы kТ-ға тең.
Тербелмелі еркіндік дәреженің энергиясы 2 есе үлкен, себебі ондағы потенциалдық және кинетикалық энергиялардың орташа мәніндегі шамасы тең шамада бола алады.
Сөйтіп, молекулалның орташа энергиясы: ‹έ›=ị/2 kT, мұндағы
ị = ịтура + ịайн+2ịтерб. Классикалық теорияда молекуланың атомдары арасындағы қатаң байланысы қарастырылады: олар үшін і молекуланың еркіндік дәрежесіне сәйкес келеді. Идеал газдағы молекулалар өзара әсерлеспейді және олардың потенциалдық энергиясы 0-ге тең. Сондықтан 1 моль идеал газдың ішкі энергиясы Ủμ және массасы m газдың ішкі энергиясы U былай жазылады:

26. Термодинамиканың 1-ші бастамасы.
Термодинамиканың 1-ші бастамасы - термодинамикалық процесте энергияның сақталу және айналу заңы.
Жүйенің ішкі энергиясын 2 әдіспен өзгертуге болады: жүйеде жұмыс істеу арқылы (мысалы, цилиндрдегі газды поршень көмегімен сығу арқылы) немесе жүйеге жылу беру арқылы (герметикалық ыдыста газды қыздыру).
Жабық макроскопиялық қозғалмайтын жүйені қарастырсақ.
∆Ú=Q-A немесе Q=∆Ú+A болады.
Термодинамиканың бірінші бастамасы: жүйеге берілетін жылу оның ішкі энергиясының өзгеруіне және сыртқы күштерге қарсы жасалатын жұмысына кетеді.
Диференциалды формада: δQ=dÚ+δA,
мұндағы dÚ - толық дифференциал, ішкі энергияның шексіз аз өзгеруі,
δA- элементар жұмыс, δQ - шексіз аз жылу мөлшері.
δA және δQ толық дифференциал емес, өйткені ішкі энергия жүйе күйінің бірмәнді функциясы.
Осыдан кейін, толық ішкі энергияның өзгерісі ∫ dÚ=0, ол қайтадан бастапқы күйге айналады. Жылу да, жұмыс та күй функциясы бола алмайды. Термодинамиканың 1-ші бастамасына кіретін шамалардың барлығы оң және теріс болады. Егер жылу δQ>0 болса, онда жүйеге жылу беріледі, ал егер δQ<0 болса, онда жылу алынады. Егер жүйе сыртқы денеге жұмыс жасайтын болса, онда δА>0, егер жүйеге сыртқы күштер жұмыс жасаса, онда δА<0.
Термодинамиканың 1-ші бастамасының басқа формуласы, егер жүйе периодты түрде бастапқы күйге келсе және ∆Ú=0 болса, онда A=Q, яғни 1-ші текті тұрақты двигатель – периодты әсер етуші двигатель мүмкін емес.
27. Ұлғаю кезіндегі газдың жұмысы.
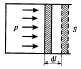
Егер поршень цилиндрлі ыдыста болса, онда газ ұлғайып поршеньді жылжытады, арақашықтығы dl, онда жұмыс былай болады:
δA=Fdl=psdl=pdv, s- поршеннің ауданы.
Газдың көлемін V1-ден V2-ге өзгерткен кездегі толық жұмыс A мынаған тең: 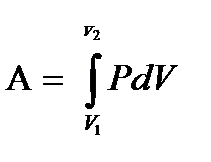
Тепе-теңдік процестер - бұл процестер, тізбектелген тепе-теңдік құрамдардан тұрады. Барлық реалдық процестер тепе-теңсіз, бірақ кейбір жағдайдағы (жеткілікті баяу процестер) тепе-теңсіз реалдық процестерге тепе-теңдік мәндер беруге болады. Тепе-теңдік процестерді графикалық координаттар (p,v) бейнелейді. Ондағы жұмыс δA=pdv штрихталған жолақтардың ауданымен анықталады, ал толық жұмыс - V1 және V2 аралығындағы қисық астындағы аудан.

Тепе-теңсіз процесте – параметр мәндері жүйенің әртүрлі бөлігіндегі және әртүрлі барлық жүйені сипаттайтын (p,v) – нүктесі болмайды. Сондықтан тепе-теңсіз процестің графикалық бейнесі болуы мүмкін емес.
28. Жылусыйымдылық.
| C=δQ/mdT Cμ=δQ/vdT. Cμ=cμ |
Заттың меншікті жылусыйымдылығы C – 1кг
затты 1К-ге қыздырғандағы кеткен шама. Өлшем
бірлігі - Дж/(кг*К)
Мольдік жылусыйымдылық Сμ –заттың 1 молін
1К-ге қыздырғандағы кеткен жылу мөлшеріне
тең шама. Өлшем бірл.- (Дж/моль*К)
Cμ ж/е C арасындағы байланыс:
Егер заттарды қыздыру процессі кезінде оның көлемі немесе қысымы тұрақты болса, онда тұрақты көлемдегі (сv және Сv) және тұрақты қысымдағы (ср Ср) жылу сыйымдылықтарды (меншікті және мольдік) ажыратамыз.
29. Тұрақты көлемдегі мольдік жылу сыйымдылық.
ΔА=pdV және Сμ=δQ/VdT екенін ескере отырып термодинамика-ның бірінші бастамасынан δQ=dU+δA, 1 моль газ үшін мына формуланы аламыз:
Сμ d T = d Uμ + РdVμ
V = const болғанда, сыртқы күштердің жұмысы 0 – ге тең (δ A =0) және
газға сырттан берілетін жылу тек қана оның ішкі энергиясын көбейтіп, ұлғайтуға жұмсалады
СV = d Uμ / dT
СV - температураны 1К – ге көтерген кездегі 1 моль газдың ішкі энергиясының өзгеруіне тең.
d Uμ = ½ RdT болса, онда СV = ½ R болады.
30. Тұрақты қысымдағы молярлы жылу сыйымдылық.
Майер теңдеуі.
Егер газ Р = const кезінде қыздырылса, онда
Ср = δQ / VdT = (d U + РdV) / VdT = d Uμ / dT + РdVμ / dT
Мұндағы d Uμ / dT - процестің түріне тәуелді емес (идеал газдың ішкі энергиясы P және V – дан тәуелді емес, ол тек Т арқылы анықталады) және әрқашан Сv – ға тең.
Клапейрон – Менделеевтің РVμ = RT теңдеуін Р = const кезінде Т бойынша дифференциалдасақ мынаны аламыз:
Ср = Сv + Р - Майер теңдеуі.
Ср әрқашан Сv – дан универсалды газ тұрақтысы шамасына үлкен.
Бұл, газды тұрақты қысымда қыздыру үшін, қысымның тұрақтысы газ көлемінің ұлғаюымен қамтамасыз етілген сияқты, газдың ұлғаю жұмысын орындау үшін тағы да қосымша мөлшерде жылу керек болуымен түсіндіріледі.
Ср = ½ R + R = (i + 2) /2 * R
Термодинамикалық процестерді қарастырған кезде негізгі ролді мына шама көрсетеді:
γ = Ср / Сv = (i + 2) / 2; - ол Пуассон коэфициенті деп аталады.
ИЗОПРОЦЕСТЕР. Негізгі параметрлерінің біреуі тұрақты сақталатын
термодинамикалық жүйелермен болатын тепе-теңдік процестерді
қарастырамыз.
31. Изохоралық процесс (V = const).
Бұл процестің диаграммасы - изохора. Ол (P,V) координатасында ордината осіне (Р осі) параллель жүргізілген түзу ретінде сипатталынады.
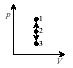
2 – 1 арасындағы процесс - изохоралық қызу, 2 – 3 арасындағы процесс - изохоралық салқындау.
Изохоралық процесс кезінде газ сыртқы денелердің үстінен жұмыс істемейді.
( δА = рdV = 0 ) және газға берілетін барлық жылу ішкі энергияның ұлғаюына жұмсалады (δQ = d U).
d Uμ = Сv dТ болғандықтан, газдың кез-келген массасы үшін:
δQ = m/μ * Сv dТ болады.
32. Изобаралық процесс. (Р = const).
Бұл процестің диаграммасы - изобара. Ол (PV) координатасында абцисса осіне (V осі) параллель жүргізілген түзу ретінде сипатталынады.
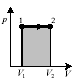
Изобаралық процесте көлемнің V1 - ден V2 - ге ұлғаюы кезіндегі жұмыс мынаған тең: v2
А = ∫ pdV = p (V2 – V1) және ол
V1
штрихталған тікбұрыштың ауданымен анықталынады.
рV = 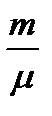 RT Клапейрон теңдеуін қолданып, мынаны аламыз:
RT Клапейрон теңдеуін қолданып, мынаны аламыз:
V2 - V1 = 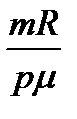 (T2 - T1), бұдан А =
(T2 - T1), бұдан А = 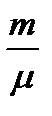 R (T2 - T1 ).
R (T2 - T1 ).
Универсалды газ тұрақтысының физикалық мәні: R – 1K-ге қыздырғандағы идеал газдың 1 молінің изобаралық кеңею жұмысына тең.
33. Изотермиялық процесс (T = const).
Бұл процестің диаграммасы - изотерма. Ол (P,V) координата-сында гипербола ретінде сипатталынады. Изотермиялық процесс Бойль –Мариот заңымен сипатталынады. (PV = const).

Газдың изотермиялық кеңеюінің жұмысы
v2 v2
А = ∫ pdV = ∫ 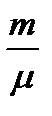 RT
RT  =
= 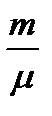 RT ln
RT ln 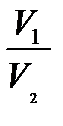 =
= 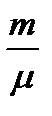 RT ln
RT ln 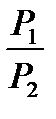 ;
;
V1 V1
T = const болғанда идеал газдың ішкі энергиясы өзгермейді, сонда термодинамиканың бірінші бастамасынан δQ = δА екені шығады, яғни, газға берілетін барлық жылу мөлшері сыртқы күштерге қарсы жұмыс жасауға жұмсалынады. Сондықтан, газдың ұлғаюы кезінде температура төмендемеу үшін, газға изотермиялық процесс кезінде эквивалентті ішкі ұлғаю жұмысының жылу мөлшерін беру керек.
34. Адиабаталық процесс (δQ=0).
Адиабаталық процесс деп – жүйе мен қоршаған орта арасында жылу алмасу болмаған процесті айтамыз (δQ=0).
Адиабаталық процеске барлық тез өтетін процестерді жатқызуға болады
(жылу алмасу болып үлгермейді). Мысалы, дыбыстың ауада таралуы, ішкі жану двигателіндегі кеңею және қысылу циклі т.б.
Термодинамиканың бірінші бастауынан адиабаталық процесте δА = - d U
болады.
δА = pdV және d U = 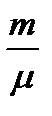 R Сv dТ формуласын пайдаланып, мынаны аламыз: pdV = -
R Сv dТ формуласын пайдаланып, мынаны аламыз: pdV = - 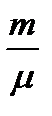 Сv dТ (1)
Сv dТ (1)
Басқа жағынан қарасақ, pV = 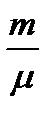 RT формуласынан мынау шығады: pdV + Vd Р =
RT формуласынан мынау шығады: pdV + Vd Р = 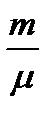 RdT (2)
RdT (2)
(2) – ні (1) – ге бөлсек:
 =
= 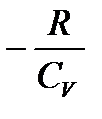 = -
= - 
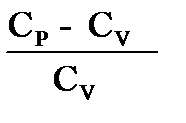 немесе
немесе  = -
= - 
 ,
,
мұндағы  =
= 
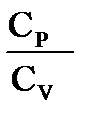 - Пуассон коэффициенті.
- Пуассон коэффициенті.
PV  = const = const
|
Осы теңдеуді интегралдасақ: lg V  + lg P = lg const
+ lg P = lg const
Бұл адиабаталық процестің Пуассон теңдеуі береді.
Менделеев –Клапейрон pV = 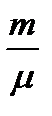 RT теңдеуін ТV
RT теңдеуін ТV  -1 = const
-1 = const
Пайдаланып, мынаны аламыз: Т 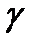 р1 -
р1 -  = const
= const
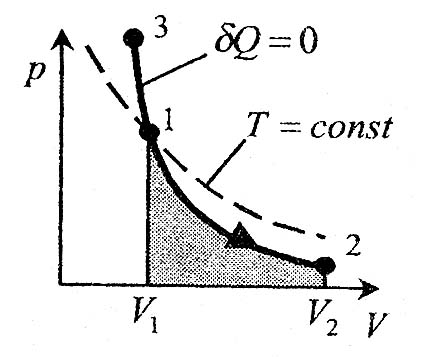
Адиабаталық процестің диаграммасы - адиабата. Ол (P,V) координатасында гипербола болып сипатталынады. Адиабата (PV  = const) изотермаға (PV = const)қарағанда қарағанда тіктеу болып келеді.Ол адиабаталық процесс кезінде 1 – 3 аралығында газ қысымының ұлғаюы – көлемнің азаюымен қатар температураның көтерілуімен түсіндіріледі.
= const) изотермаға (PV = const)қарағанда қарағанда тіктеу болып келеді.Ол адиабаталық процесс кезінде 1 – 3 аралығында газ қысымының ұлғаюы – көлемнің азаюымен қатар температураның көтерілуімен түсіндіріледі.
35. Адиабаталық процестегі газдың жұмысы.
Адиабаталық процесте δА =-d U, сондықтан δА = - 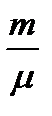 Сv dТ.
Сv dТ.
Егер газ адиабаталық түрде V1- ден V2 көлеміне дейін ұлғайса, температурасы T1 –ден T2 - ге дейін азаяды, онда идеал газдың ұлғаю жұмысы
Т2
А = - 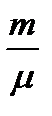 Сv ∫ dТ =
Сv ∫ dТ = 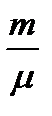 Сv (Т1 - Т2)
Сv (Т1 - Т2)
Т1
Бұдан Менделеев – Клапейронның PV = 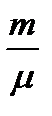 RT теңдеуін пайдаланып мынаны аламыз:
RT теңдеуін пайдаланып мынаны аламыз:
А = 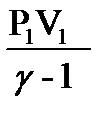 [1 - (
[1 - (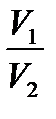 )
)  - 1 ] =
- 1 ] =  [1 - (
[1 - (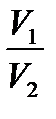 )
)  - 1 ]
- 1 ]
1-2 адиабаттың ұлғаю кезіндегі жұмыс (штрихталған аудан) изотермалық процестен кем. Себебі, адиабаттық ұлғаю кезінде газ температурасы төмендейді, ал изотермиялық ұлғаюда температура сырттан келетін эквивалентті жылу есебінен тұрақты күйде ұсталып тұрады.
36. Политропты процесс. (С=const)
Жылу сыйымдылық тұрақты болып (С=const) қалатын процесс - политроптық деп аталады.
Жоғарыда қарстырылған изохоралық, изотермалық, изобаралық және адиабаталық процестер осы политроптық процестің кейбір жағдайлары болып саналады.
Политроп теңдеуі pVn = const
Мұндағы n =  - политроп көрсеткіші деп аталады.
- политроп көрсеткіші деп аталады.
Жылу сыйымдылық мәндері мен политроп көрсеткіштері әр түрлі процесстерге байланысты таблицада көрсетілген.
| Процесс | С | n |
| Адиабаталық Изотермиялық Изобаралық Изохоралық | C = 0 C = ¥ C = Ср C = Сv | n = g n = 1 n = 0 n = ±¥ |
dT=0, dQ¹0 болғандықтан изотермалық процесс кезінде жылу сыйымдылық шексіз үлкен. dQ = 0 болғандықтан адиабаталық процесс кезінде жылу сыйымдылық 0-ге тең.
37. Айналмалы процесі. (цикл)

Айналмалы процесс (циклдік) деп (P,V) диаграмасында цикл тұйық қисықпен сипатталатын процесті айтамыз. Мұнда 1-2 бөлігі ұлғаюға сәйкес келсе, ал 2-1 газдың сығылуы.
Ұлғаю жұмысы A1 (1a2V2V11 фигурасының ауданы) оң: A1 >0
Сығу жұмысы A2 (2б1V2V12 фигурасының ауданы) теріс: A2<0
Циклдегі жұмыс А тұйық қисықтың сызған ауданымен анықталады: А=A1 + A2
Жұмыс – термодинамикалық жүйе күйінің функциясы ғана емес, сонымен қатар болған процестің түрінің функциясы болып саналады. Сондықтан жұмыс күйдің бір мағыналы фунциясы болып саналмайды (ішкі энергия сияқты).
Термодинамиканың бірінші бастамасынан жылу Q жұмыс А сияқты жүйемен болатын процестің функциясы болып саналады.
38. Айнымалы процесс үшін ПӘК
Айнымалы процесс нәтижесінде жүйе бастапқы күйге қайтып келеді, яғни ішкі энергияның толық өзгерісі нөлге тең болады. Сондықтан Q=DU+A=A, яғни цикл үшін жасалатын жұмыс алынған жылулықтың көлеміне тең. Егер айналу процесі кезінде жүйе тек қана Q1 жылу мөлшерін алып қана қоймай Q2 жылу мөлшерін жоғалтса, онда Q = Q1-Q2 болады.
Айналмалы процесс үшін термиялық пайдалы әсер коэффиценті –бұл жүйеде жасалған жұмыстың жүйеге берілген жылуға қатынасына тең физикалық шама.
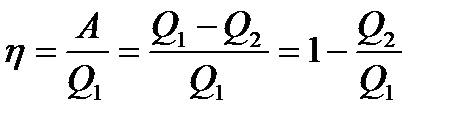
39. Қайтымды және қайтымсыз процестер.
Термодинамикалық процесс қайтымды деп аталады, егер ол түзу бағыттада, кері бағытта да жасала алса. Егер мұндай процестер алдымен түзу бағытта, одан кейін кері бағытта жасалса және жүйе бастапқы күйге келсе, онда қоршаған ортада және де осы жүйеде ешқандай өзгеріс болмайды. Бұл шарттарды қанағаттандырмайтын басқа процестер қайтымсыз болады.
Нақты процестер қайтымсыз, онда әрқашанда энергияның диссипациясы (жоғалту, үйкелістен, жылуөткізгіштен және т.б.) болады. қайтымды процестер - бұл физикалық модель - нақты процестердің идеализациясы.
Дата публикования: 2015-10-09; Прочитано: 2306 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
