 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Карно теоремасы
|
|
Қыздырғыш температурасы Т1 және мұздатқыш температурасы Т2 бірдей барлық периодты түрде жұмыс жасайтын жылу машиналарының ішіндегі ең көп ПӘК қайтымды машиналарда болады. Қыздырғыш пен мұздатқыштарының температуралары бірдей жағдайда істейтін қайтымды машиналардың ПӘК-і бір – біріне тең және жұмысшы дененің табиғатына байланысты емес, тек қана қыздырғыш пен мұздатқыштың температураларына ғана байланысты
48. Карно циклы.

Айналым процесі екі изотермиядан және екі адиабаттан тұрады. Карноның тура циклын қарастырайық: жұмысшы дене орнына идеал газ қолданады. Карно циклындағы термодинамикалық процестер: 1-изотерма-2-адиабата-3-изотерма-4-адиабата-1:
| Изотермиялық ұлғаю 1-2 Т=const; V2.>V1 | A12=m/μ RT1 ln V2 /V1 =Q1 |
| Адибаталық ұлғаю 2-3 δQ=0; T2<T1 | A23 =-m/μ Cv (T2 –T1) |
| Изотермиялық қысылу 3-4 T=const V4<V3 | A34 =m/μ RT2 ln V4 /V3=-Q |
| Адибаталық қысылу δQ=0; T1>T2 | A41 =-m/μ Cv (T1 –T2)=-A23 |
Айналым процесіндегі жұмыс: А=А12 + А23 +А34+А41=Q1+A23-Q2+A23=Q1-Q 2
2-3 және 4-1 адиабат үшін Пуассон теңдеуі: T1V2γ-1= T2V3γ-1, T1V1γ-1=T2 V 4γ-1 бұдан, V1/V2=V3/ V4
Осыны пайдалана отырып, Карно циклындағы термодинамикалық ПӘК-ты табамыз:

ол тек қыздырғыш пен тоңазытқыштың температураларымен анықталады.
| Реал газдар, сұйықтар және қатты денелер. |
Реал газдарды қарастырғанда ең алдымен молекуланың көлеміне және молекула аралық әсерлесуге көңіл аудару керек.
Молекула аралық әсерлесу күштері 10-9 м кем аралықта көрінеді. Молекулааралық әсерлесу күші - бұл тартылу күші Fn (олар үлкен аралықта байқалады) және тебілу күші F0 (олар кішкентай аралықта байқалады). Екеуінің қосындысы (айырымы) r = r0 аралықта бұл күштер тең және F=0 қалыпқа келеді. r0 аралық молекулар арасындағы тепе-теңдік кезіндегі қашықтық, бұл жылулық қозғалыс жоқ кезде болады.
Ең мықты r=r0 тепе-теңдігінде өзара әсерлесу потенциалдық энергиясы U ең аз шамада болады.
Umin және kT бұл әр түрлі агрегаттық күйлердің критерийлері.
Umin жұмысты анықтайды, оны қалыптағы молекулаларды (r=r0) айыру үшін
тартылыс күшіне қарсы орындау керек.

Umin<< KT кезінде заттар газдық күйде болады, себебі молекулалардың жылулық қозғалысы олардың қосылуына (конденсация) кедергі жасайды.
Umin >> KT кезінде заттар қатты күйде болады, себебі молекулаларды бір-бірінен “ажыратуға” жылулық энергиясының күші жеткіліксіз.
Umin = KT кезінде заттар сұйық күйде болады, себебі жылулық қозғалыс нәтижесінде молекулалар кеңістікте орындарын ауыстыру арқылы қозғалыста болады, бірақ бір-бірінен r0-ден көп қашықтамайды.
49. Ван-дер Ваальс теңдеуі.
Идеал газ күйіне PVμ = RT молекула көлемін және молекула аралық күштердің әсерлесуін ескере отырып өзгеріс енгізсек реалдық газдың көлемін Vμ—b аламыз. Радиусы r екі молекула 2r аралыққа дейін қосыла алмайды. b көлемі 1молекуланың көлемінен 8 есе артық.

Молекулааралық күштердің тартылысы газға қосымша қысым P/ арқылы беріледі, оны ішкі қысым дейміз: P′=a/V2μ мұндағы а - Ван-дер–Ваальс тұрақтысы. Мольдік газ үшін Ван-дер-Ваальс теңдеуі – реал газ күйінің теңдеуі:
(P+ a/V2μ) (Vμ-b)=RT
Кез-келген газ массасы үшін:
(P+V2a/V2)(V- νb) = VRT, мұндағы, ν = m/μ, V=νVμ.
50. Реал газдардың изотермалары.
Реал газдардың изотермасы молярлық газдың көлемінің, температура тұрақты болғанда, қысымға тәуелділігін көрсетеді.
(T > TK) жоғары температурада реал газдың изотермасының идеал газдың изотермасынан айырмашылығы көп емес.

Кризистік температура ТК температура кезінде–изотермасының К нүктесінде доға (қисаю нүктесі) пайда болады. Осы нүктеге сәйкес келетін VK көлем және РК қысым кризистік деп аталады. ТК кезіндегі изотерма кризистік изотерма деп аталады.
Т<ТК кезіндегі Ван-дер-Ваальс теңдеуі 1-2-3-4-5-6-7 қисыққа сәйекес келеді. (5-3 учаскесінде заттар аз қысымда болады). Бірақ 5-3 учаскесінде заттың қысылуы қысымның азаюымен өтеді, осы облыста заттар екі фазаға бөлінеді: сұйық және бу.
Фаза – жүйенің барлық бөлігінің бірдей химиялық құрамда және бірдей химиялық күйде болуы.
Реал газдың шын кризистік иозтермасының түрі мынадай болады: 1-2-6-7- заттың газ күйінің (Г) (6-7 учаскесінде) үздіксіз сұйыққа (Ж) (участок 2-1) ауысуы. 6-2 учаскесі сұйық пен газдың тепе-теңдігіне сай келеді.
Газ күйіндегі заттар температура критикалық температурадан аз кезінде бу деп аталады (П), ал өзінің сұйықтығымен тепе-теңдік кезіндегі бу қаныққан бу деп аталады (Ж+П). Изотермалық қысылу кезінде газ сұйыққа айналады.
Т>TK температура кезіндегі газ сұйыққа айналуы мүмкін емес, қандай қысымда болмасын. 5-6 және 2-3-метатұрақты күйлер, 2-3-аса қызған сұйық, 5-6-аса қаныққан бу.
51. Реал газдың ішкі энергиясы.
Реалдық газдың ішкі энергиясы (CvT) жылулық қозғалысының кинетикалық энергиясынан және молекулааралық әсерлесудің потенциалдық энергиясынан (-a /Vμ) тұрады: Uμ=CvT- a/Vμ.
Егер газ қоршаған ортамен жылу алмасусыз ұлғайса (адибатикалық dQ=0) және жұмыс істемесе (ваккумдағы газдың ұлғаюы dA=0) бірінші термодинамикалық бастаудан
(dq=(U2-U1)+ da) болады, бұдан: U1=U2
Адибаталық ұлғаю кезінде жұмыс істелмесе газдың ішкі энергиясы өзгермейді.
Идеал газ үшін Т1 =T2 (температура өзгермейді)
Реалдық газ үшін U = Cv T-a/V сондықтан:

Реал газ ваккумда адибаталық ұлғаю кезінде салқындайды.
52. Сұйықтар және олардың сипаттары.
Сұйық - заттың агрегаттық күйі болып табылады, газ бен қаттының арасындағы өтпелі күй. Газдарда молекулалар орналасуының заңы болмайды. Қатты денелердің орналасуы - молекулалар кристалдық тор құрады, оларда алыс рет сақталады, сұйықта рет болмайды, молекулаларының орналасуында жақын рет болады, молекулалардың тәртіпті орналасуы молекулааралық қашықтықтан артпайды.
Радиус r - молекулалық әрекеттесу арақашықтығы (10-9 м шамасында) сұйықтық молекулалары арасындағы тартылыс күшті санамауға болады.

Радиусы r шарды молекуланың әрекеттесу шары деп атаймыз. сұйықтың ішкі көлеміндегі А молекуласына қоршаған орта молекулалары тарапынан әсер етуші күштер орта есеппен компенсацияланған. Сыртта орналасқан В молекулаға әсер етуші R күші сұйықтың ішіне қарай бағытталған. Беттік қабаттағы барлық молекулалардың қорытынды күші сұйыққа молекулалық (ішкі) қысым түсіреді.
53. Беттік тартылу.
Сұйықтың беттік қабатының молекулалары сұйықтың ішкі молекулаларына қарағанда потенциалдық энергиясы көп болады. Бұл қосымша энергия беттік энергия деп аталады, ол беттік ауданға пропорцинал болады:
DЕ = 6D S, мұндағы 6- беттік тартылу.
Тепе-теңдік күй потенциалдық энергияның минимумымен сипатталады, сондықтан сыртқы күш болмаған кезде сұйықтың бетінің көлемі минималдық - шардың формасында болады. Сұйықтың беткі қабаты тартылу күші әсер ететін созымтал серпімді пленкаға ұқсайды.

Беттің керілу күшінің әсерінен сұйықтың беті тырысты делік, сонда (суретке қара) осы кезде контурдың Dl элементіне әсер ететін 6 күш,
DА = fDlDx, мұндағы f- тартылу күші, сұйықтықтың бетінің контурының бірлік ұзындығына байланысты әсер етеді. Бұл жұмыс беттік энергияның азаю есебінен жасалынады, яғни DА=DE болса, онда σ=f, σ-беттің керілу күшінің контурдың бірлік ұзындығына әсер ететін беттік керілу күшіне тең. Беттік керілу бірлігі - Ньютонның метрге қатынасы (Н/м) немесе джоульдің квадрат метрге қатынасына (Дж/м2) тең.
54. Жұғылу.
Жұғылу деп сұйықтың қатты дененің бетімен қосылыуындағы қисаю құбылысын айтамыз.
Қатты денемен шекарасындағы сұйықтың қисайған беті мениск деп аталады.
Менискінің қатты денемен қиылысқандағы сызық, жұғылу периметрі деп аталады.
Жұғылу құбылысы қатты дене бетінің және қиылысу нүктесіндегі мениск арасындағы шеттік бұрышпен–θ-сипатталады (жұғылу периметрлерінің нүктелерінде).

Қатты денеге жұғылатын сұйықтық деп шеттік бұрышы үшкір болған
денені айтамыз: 0 ≤ θ < π/2 (а - сурет) және жұқпайтын деп π/2 < θ< π
денені айтамыз (б - сурет).
Егер θ = 0 болса, онда жұғылу идеалды (толық) болып есептеледі. Ал
θ = π жағдайында бұл идеалды жұқпау болады.
Егер қатты денелер және сұйықтықтың молекуларының арасындағы тартылыс күші, сұйықтықтың молекулаларының бір-біріне деген тартылыс күшінен көп болса, онда сұйықтық жұғылатын болады. Егер сұйықтың молекулаларының арасындағы тартылыс күші сұйықтың молекулаларының қатты дене молекулаларына тартылыс күшінен көп болса, онда сұйықтық қатты денеге жұқпайды.
55. Сұйықтықтың қисық бетінің қысымы.
Сфералық дөңес бет сұйықтыққа қосымша қысым береді, ол ішкі күштердің тартылысымен келтіріледі және сұйықтықтың ішіне бағытталады, 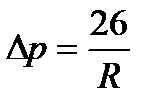 мұндағы R-сфера радиусы. Егер сұйықтықтың беті ойыс болса, онда қорытынды сұйықтық тартылыс күші cұйықтықтан болады және қысым сұйықтықтың сыртына бағытталады.
мұндағы R-сфера радиусы. Егер сұйықтықтың беті ойыс болса, онда қорытынды сұйықтық тартылыс күші cұйықтықтан болады және қысым сұйықтықтың сыртына бағытталады.
Радиусы R сабын көбігінің ішіндегі артық қысым екі беттің арасындағы жұқа пленканың сфералық бетін береді: Δρ=4σ/R
Жалпы жағдайда сұйықтық бетінің артық қысымы Лаплас формуласымен сипатталады, ол мына түрде болады:
Δρ = σ(1/R1+1/R2)

мұндағы R1 және R2 – қисықтың радиусы.
Қисықтың радиусы оң, егер қисықтың центрі сәйкесінше сұйықтықтың ішінде болса, және теріс, егер қисықтың центрі сұйықтықтың сыртында жатса.
56. Капилярлық құбылыс.
Капиляр деп цилиндрлік трубканы айтамыз, оның диаметрі миллиметрден аз болу керек.
Капилярлық деп капилярдағы сұйықтықтың деңгейінің өзгеруін айтады.
Капилярдағы сұйықтық h биіктікке көтерілсе немесе төмендесе, онда сұйықтық бағанасының қысымы (гидростатикалық қысым) ρgh артық қысымы Δρ теңеседі:
2s/R = ρgh

Капилярлы сұйықтықтың көтерілу (төмендеу) биіктігі:
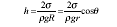
Мұндағы ρ–сұйықтықтың тығыздығы, r-капиляр радиусы, R- мениск қисығының радиусы, g-еркін түсу үдеуі.
57. Кристалдық және аморфты қатты денелер.
Қатты дене деп заттың пішіні (формасы) мен көлемі тұрақты агрегаттық күйін айтамыз. Қатты денелер кристалдық және аморфты болып бөлінеді.
Кристалл денелер – бұл қатты денелер, олардың бөлшектері қайталанбалы және бірқалыпты болады.
Кристалдық тор бөлшектің қайталанбалы, периодты үш бағытта орналасуымен сипатталады. Бөлшектер орналасқан нүктеде қозғалыста болады, оларды біз кристалдық тордың түйіні деп аталады.

Аморфты деп, қатты денелердің физикалық қасиеттері барлық бағытта бірдей болуын айтамыз.
Аморфты дене сұйықтықтағы сияқты бөлшектердің орналасуында жақын тәртіппен сипатталады.
58. Кристалдардың типтері.
Кристалдық тордың түйінінде орналасқан бөлшектердің түріне және олардың арасындағы күштердің сипатына байланысты, кристалдар 4 түрге бөлінеді: иондық, атомдық, металдық, молекулалық.
Иондық кристалдар. Кристалдық тордың түйініндегі орналасқан иондар алма-кезек қарама-қарсы таңбамен орналасады. Көп кездесетін екі иондық кристалдық тордың – NaCl (ұқсас екі гранецентрлік кубтық торлар бір-біріне жабысқан түрде болады; осы торлардың біреуінің түйіндерінде Na+ ионы орналасады, ал басқа түйінінде – Cl ионы орналасады), және CsCl (кубтық көлемдік центрлік тор - әр элементтар ұяшықтардың центрінде ион орналасады) құрылысы суретте көрсетілген.

Әртүрлі зарядталған иондардың арасындағы Кулон күштерінің тартылыс байланысын иондық байланыс деп атаймыз.
Атомдық кристалдар. Кристалдық тордың түйіндерінде орналасқан
нейтралды атомдар кванттық-механикалық тұрғыдағы ковалентті байланыстармен торлардың түйіндерінде ұстанып тұрады. (көрші атомдардың валенттік электрондары қауымдастырылады).


Атомдық кристалдардың мысалы – алмаз және графит. Алмазда әр көміртегінің атомы төрт осындай атомдармен байланысты, олар тетраэдрдың төбелерінде бірдей қашықтықта орналасады. Графитте көміртегі атомдары жұқа беттерде орналасқан, өзара әлсіз Ван-дер вальстік күштерімен байланысқан.
Металдық кристалдар. Кристалдық тордың түйіндерінде металдардың оң иондары орналасады. Атомдармен әлсіз байланысқан кристалдық торлар құрылғанда валенттік электрондар атомдардан ажыратылады және коллективтендірленеді: олар иондық байланыстағы жағдайдағы сияқты бір атомға жатпайды, коваленттік байланыстағыдай көрші екі атомға да жатпайды, олар бүкіл кристалға ортақ болады.
Молекулярлық кристалдар. Кристалдық тордың түйіндерінде заттардың нейтралды молекулалары орналасады, олардың арасындағы өзара әсер күштері атомдардың электрон қабықшаларындағы ығысуымен шартталады. Бұл күштер ван-дер-ваальстік деп аталады, себебі олар молекулалардың арасындағы тартылыс күшінің табиғатына ұқсас. Молекулярлық кристалдарға мысал ретінде – органикалық қосылыстар (мысалы, парафин), инерттік газдар (Ne, Ar, Kr, Xe) және қатты, мұз және т.б. түрдегі атмосфералық газдар CO2, O2, N2 жатады.
59. Кристалдардағы ақаулар.
Кристалдық тордың ақаулары деп олардың түйіндерінде реттеліп орналасуының бұзылуы. Ақаулар екіге бөлінеді: макроскопиялық - кристалдардың құрылуында және өсу процесінде пайда болады (мысалы: жарық, тесік) және микроскопиялық - периодтықтан микроскопиялық аутқуы.
Микроақаулар нүктелік және сызықтық болып бөлінеді. Нүктелік ақаулар үш типті болады:

1) вакансия – кристалдық тордың түйінінде атомның жоқ болуы (а - сурет)
2) түйін арасындағы атом – түйіндер арасындағы кеңістікке кірген атом (b - сурет);
3) қоспалық атом – қоспалы атом, немесе кристалдық тордың негізгі атомын ауыстыру (ауыспалы қоспа (с - сурет)).
Нүктелік ақаулар кристалдардың жақын орналасқан реттілігін бұзады.
Сызықтық ақаулар алыс реттілікті бұзады. Сызықтық ақаулардың аса маңызды болып табылатыны ішінде дислокация – сызықты ақаулар, олар атомдық жазықтықтың дұрыс алма-кезегін бұзады

60. Қатты денелердің жылу сыйымдылығы.
Идеал кристалдық торды қарастырамыз, онда түйіндердегі бөлшектер материалдық нүктелер ретінде, үш өзара перпендикулярлық бағытта (үш тербелістер, олар kT энергиямен қамтамасызданады) орналасқан және тербелісте болады.
Қатты денедегі молдің ішкі энергиясы Uμ=3NА kТ=3RT, мұндағы NА – Авогадро саны, R- молярлық газ тұрақтысы.
Қатты дененің мольдік жылусыйымдылығы:
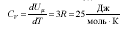
Бұл Дюлонг және Пти заңы – химиялық жай денелердің мольдік жылу сыйымдылығы кристалдық күйде бірдей (3R-ге тең) және температураға тәуелді емес.
Егер қатты дене химиялық қосылыс болып табылса (мысалы NaCl), онда молдегі бөлшектер саны nNА, мұндағы n – молекуладағы атом саны (NaCl үшін молдегі бөлшек саны 2NА – ға тең, өйткені NaCl – дың бір молінде NА NА атомы және NА CL атомы бар).
Қатты химиялық қосылыстардың молярлы жылусыйымдылығы:
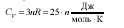
61. Агрегаттық күйдің өзгерісі.
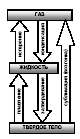
Сұйықтарда да, қатты денелерде де басқа молекулалардың тартылыс күшіне қарсы тұратын және сұйықтың немесе қатты дененің бетін тастап шыға алатын молекулалар бар. Мұндай процесс сұйықтықтар үшін булану, қатты дене үшін балқу деп аталады. Конденсация дегеніміз заттың газдалған түрінен сұйықтыққа айналуы.
Егер бірлік уақытта сұйықтықты тастайтын молекулалардың саны будан сұйықтыққа ауысатын молекулалардың санына тең болса, онда осы кезде булану мен конденсация арасында динамикалық тепе- теңдік пайда болады. Бу өзінің сұйық түрімен тепе – теңдікте болса, қаныққан деп аталады.
Балқу дегеніміз заттың кристалды түрінен сұйықтыққа айналуы.

Балқу белгілі бір ішкі қысым әсерінен болады, балқу температурасы - Тбалқ..
Балқу процесінде затқа кететін жылу Q, кристалдық торды ыдырату жұмысына кетеді, сондықтан да барлық кристалдың балқуы үшін Тбалқ. = const (сурет а)
1 кг затты балқыту үшін қажет L жылу мөлшері меншікті балқу жылуы деп аталады.
Егер сұйықтықты салқындатса процесс керсінше болады. (сурет (б), Q/ - кристалдану кезінде дене берген жылу мөлшері): алдымен сұйықтықтың температурасы төмендейді, содан соң бірқалыпты Тбалқ. температурасында кристалдану басталады.
Заттың кристалдануы үшін зат құрайтын кішкене кристалдар- кристалдану орталығы болуы қажет. Егер таза сұйықта кристалдану орталығы болмаса, онда ол кристалдану температурасынан кіші температураға дейін салқындатылады, ол аса салқындатылған сұйық болып табылады. Аморфты денелер аса салқындатылған сұйықтарға жатады.
62.Фазалық ауысулар.
Тепе-теңдік күйдегі денелерден басқа физикалық қасиетіне байланысты ажыратылатын денелердің термодинамикалық тепе – теңдікті сақтауы фазалар деп аталады.
Заттың бір фазадан екінші фазаға ауысуы заттың құрамының өзгеруіне байланысты.
Фазалық ауысудың бірінші түрі – бұл ауысу жылу жұтылумен немесе жылу шығарумен анықталады. (мысалы, балқу, кристализация). Ол температураның тұрақтылығымен, энтропия мен көлемнің өзгеруімен сипатталады.
Фазалық ауысудың екінші түрі – ауысу жылу шығару немесе жұтылу және көлемнің өзгеруімен байланысты емес. Ол энтропия мен көлемнің тұрақтылығымен, жылу сыйымдылығының үрдіс өзгеруімен сипатталады. Фазалық ауысудың екінші түрісимметрияның өзгеруімен байланысты: ауысудың ең жоғарғы нүктесі төменгі нүктесінің ауысуына қарағанда жоғарғы симметриямен ерекшеленеді.
Фазалық ауысудың екінші түріне мысал: Ферромагниттік заттың белгілі бір қысымда және температурада парамагниттік күйге ауысуы, металмен қорытпаның төменгі температурада аса өткізгіш күйге өтуі, жай сұйық гелийдің аса аққыш сұйықтыққа айналуы.
63. Диаграммалық күй.
Егер жүйе химиялық біртектес заттан тұратын немесе оның қосындысы бір компонентті болса, онда фаза түсінігі агрегаттық күй түсінігімен сәйкес келеді.

Фазалық өзгеріс күйі диаграммасы түрінде алып қарайтын болсақ, (Р,Т) координатасында фазалық ауысу температурасы мен қысым арасындағы тәуелділік булану (КИ), балқу (КП) мен сублимация (КС) қисықтары түрінде беріледі, олар диаграммалық сызықты үш ауданға бөледі: олар қатты (ТТ), сұйық (ж) және газ (г) күйіндегі фазаға дәл келеді.
Әрбір нүкте берілген фазалық тепе – теңдікке сай келетін диаграммадағы қисық фазалық тепе – теңдік қисығы деп аталады. Бір нүктеде фазалық тепе – теңдік қисықтары қиылысады және ол бір қалыпты тепе – теңдіктің үш фазалық күйінің тепе – теңдігін анықтайды, ондай нүкте үштік нүкте деп аталады.
Судың үштік нүктесі 273,16 К температураға сай келеді (немесе 0,010 С Цельсий шкаласы бойынша) және термодинамикалық температураның шкаласын құру үшін негізгі реперлік нүкте болып табылады.
64. Клапейрон - Клаузиус теңдеуі.
Клапейрон - Клаузиус теңдеуі: 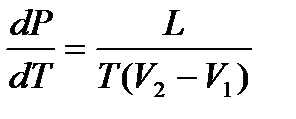 тепе – теңдік қисығының көлбеуін анықтауға мүмкіндік береді. Мұндағы L – фазалық ауысудың жылуы (мысалы, балқу кезінде - меншікті балқу жылуы), (V2 - V1) – бір фазадан екінші фазаға ауысқандағы заттың көлемінің өзгеруі, Т – ауысу температурасы (мысал, балқу кезінде – температура балқуы Тбалқ.). L және Т әрқашанда оң, онда тепе – теңдік қисықтың көлбеуі (V2 - V1) белгісімен анықталады. Сонымен булану және сублимация кезінде көлем әрқашанда өседі, сондықтан
тепе – теңдік қисығының көлбеуін анықтауға мүмкіндік береді. Мұндағы L – фазалық ауысудың жылуы (мысалы, балқу кезінде - меншікті балқу жылуы), (V2 - V1) – бір фазадан екінші фазаға ауысқандағы заттың көлемінің өзгеруі, Т – ауысу температурасы (мысал, балқу кезінде – температура балқуы Тбалқ.). L және Т әрқашанда оң, онда тепе – теңдік қисықтың көлбеуі (V2 - V1) белгісімен анықталады. Сонымен булану және сублимация кезінде көлем әрқашанда өседі, сондықтан  болады.
болады.
Балқу кезінде көп заттың көлемі өседі; сондықтан 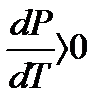 яғни қысымның үлкеюі балқу температурасын көбейтуге алып келеді. (суретте КП). Кейбір заттар үшін (су, шойын) сұйық фазаның көлемі қатты фазаның көлемінен кіші болады, яғни
яғни қысымның үлкеюі балқу температурасын көбейтуге алып келеді. (суретте КП). Кейбір заттар үшін (су, шойын) сұйық фазаның көлемі қатты фазаның көлемінен кіші болады, яғни  ; сондықтан қысымның жоғарлауы балқу температурасының төмендеуіне алып келеді. (суреттегі штрихталған сызық)
; сондықтан қысымның жоғарлауы балқу температурасының төмендеуіне алып келеді. (суреттегі штрихталған сызық)
65. Күй диаграммасын талдау.
Күй диаграммасы, заттың Р және Т- да қандай күйде болатынын анықтайды және ол кезеңде қандайда фазалық ауысулар болатынын білдіреді.

Мысалы, суретте белгіленген: 1 заттың - қатты күйде (ТТ), 2- газ күйінде (Г), 3- сұйық күйінде (Ж) және газ күйінде. 4-5-6 изобаралық қыздыру кезеңінде, 5 нүктеде балқу, ал 6 нүктеде қайнау басталады.
Ал 7-8 қыздыру кезеңінде қатты дене сұйық фазаға өтпей газға айналады. Изотермалық 9-10 қысымда зат үш кезеңнен өтеді; газ→сұйықтық→кристалл. Булану қисығы кризистік (К) нүктемен аяқталады. Сондықтан, заттың сұйық күйден үздіксіз ауысуы және керісінше булануды қиылысу қисығынсыз, яғни фазалық ауысумен жалғаспайтын кризистік нүктені айналып өтіп ауысуы мүмкін. Сондықтан заттың сұйық күйден газды күйге ауысуы кризистік нүктеге байланысты. Бұл мүмкін, себебі, газ бен сұйықтың арасындағы айырмашылық таза сапалылық болып табылады (мысалы, осы екі күйде изотроптық болып табылады). Кризистік нүкте булану қисығы үшін қандай да бір орын алады, сондықтан қисық балқу және сублимация үшін үзіліп кете алмайды, фазалық ауысу кезінде секіру түрінде ауысу кристалдық сұйық күйде немесе газ түрінде бола алады (фазалық ауысу нәтижесі).
Балқу қисығы шексіз болады, ал сублимация қисығы Р=0 және T=0 болатын нүктеге барады.
Молекулалық физика бойынша әдебиеттер тізімі.
15. Фриш С.Э., Тиморева А.В. Жалпы физика курсы. – Алматы: Мектеп. 1971. 1 том. Механиканың физикалық негіздері. Молекулалық физика.
16. Қойшыбаев Н., Шарықбаев. Физика: (оқу құралы) – Алматы, ҚазМЕМ ҒАҒЗИ, 2001ж. 1 том: Механика, Молекулалық физика және жылу.
17. Қожанов Т.С., Рысменде С.С. Физика курсы, Қаз. Аграр. Унив. – Алматы: Агроуниверситет, 2001 ж. 1 том: Механика. Молекулалық физика. Термодинамика.
18. Жұбанов М. Физиканың негізгі заңдары. – Алматы: Мектеп. 1989
19. Абдулаев Ж. Жалпы физика курсы: Оқу құралы. – Алматы: Ана тілі, 1991 ж.
20. Ақылбеков Ә. Физика: Техникалық жоғары оқу орындары студенттеріне арналған оқу құралы. – Алматы: Білім, 1997 ж.
21. Арызханов Б.С. Физика курсы: студенттерге арналған оқу құралы. – Алматы: Мектеп, 1988 ж.
22. Ахметова Б.Г., Әбілдаев Ә.Х. Физика. – Алматы: Мектеп, 1987 ж.
§9. Есептерді шығару мысалы.
Дата публикования: 2015-10-09; Прочитано: 3011 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
