 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Энтропия
|
|
dQ жылу көлемі, бір күйден екінші күйге өткендегі берілген немесе алынған жүйеде, бастапқы және соңғы күйлермен анықталмайды, бірақ осы ауысу тәсіліне тәуелді (¶Q жүйенің күй функциясы емес).
Әдетте, келтірілген жылу көлемі - жылу ¶Q жүйенің температурасы Т-ға жүйедегі күйлер шексіз аз өзгерістер қатынасы кезіндегі - күй жүйесінің функциясы. Кез- келген айналмалы жүйеде
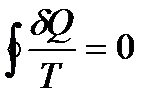
Интеграл астындағы теңдеу қайсыбір функцияның толық диференциялы, ол жүйедегі күйлердің тек қана бастапқы және соңғы мәндерімен анықталады.
Энтропия S жүйенің күй функциясы деп аталады,
дифференциялы 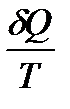 :
:
dS= 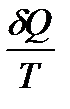
яғни, термодинамиканың бірінші бастамасын dQ= dU + dA, TdS = dU + dA түрінде жазуға болады. Бұдан dA = TdS – dU = d(TS) – SdT – dU = - d(U – TS) – SdT = - dF – SdT.
F = U – TS функциясы жүйенің күй функциясы және Гельмгольц энергиясы немесе бос энергия деп аталады.
41. Энтропияның өзгеруі .
Қайтымды процесстер үшін жабық жүйеде DS = 0; қайтымсыз циклдер үшін DS>0.
Клаузиус теңcіздігі: жабық жүйедегі энтропия өсуі мүмкін (қайтымсыз процестер жағдайында) немесе қалыпты күйде қалады (қайтымды процестер жағдайында)
dS және dQ бірдей белгі болғандықтан, яғни өзгеру сипаттамасы бойынша энтропияны жылу алмасу процесінің бағытында деп айтуға болады.
Денені қыздырғанда dQ> 0, оның энтропиясы өзгереді dS > 0, суытқанда dQ < 0 және дененің энтропиясы төмендейді dS < 0
Изоэнтропия деп тұрақты энтропия кезінде өтетін процесті айтады.
(S = const)
Қайтымды адиабаталық процесте dQ = TdS = 0, dS = 0 және S= const болғандықтан адиабаталық процесс изоэнтропиялық болады.
Мысал үшін идеал газды қарастырамыз, тепе-теңдік бір күйден екінші күйге ауысатын болғандықтан
DS1®2 = S2 – S1 = 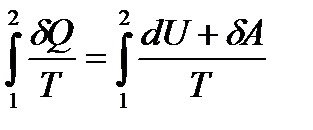 қолданылады,
қолданылады,

екенін ескерсек, онда
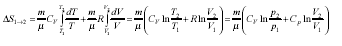
Идеал газ процестерінде энтропияның өзгеруі
| Изохоралық (V=const) | Изобаралық (p= const) | Изотермиялық (T=const) | Адиабаттық (S=const) |
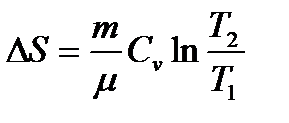
| 
| 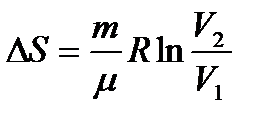
| 
|
42. Энтропияны статистикалық тұрғыдан түсіндіру.
Дененің немесе жүйенің термодинамикалық ықтималдылығы W - бұл тәсілдер саны, ол термодинамикалық күйдің нақтылануы (макро күй)
Больцман формуласы: S = k ln W
Мұндағы k - Больцман тұрақтысы.
Жүйенің энтропиясы тұрақты берілген макрокүйлерді нақтылайтын микрокүй санының логорифімен анықталады.
Энтропия ретсіз жүйенің өлшемі болады – неғұрлым макрокүйлер саны көп болса, соғұрлым энтропия көп болады.
43.Энтропияның өсу принципі.
Жабық жүйедегі барлық процесстер, оның энтропиясының өсуіне әкеледі. Энтропия, күйдің ықтималдылығы максималды болғанша, жабық жүйедегі аз ықтималдылықтан көп ықтималдыққа қарай бағытталып жүреді, Тепе-теңдік күйде күй системасының ең үлкен ықтималдылығы орындалады, мұнда микрокүйлердің саны максималды болғандықтан, энтропия да максималды болады.
44.Термодинамиканың екінші бастамасы.
Кез-келген жабық жүйедегі қайтымсыз процесс мына түрде болады - жүйенің энтропиясы өседі (энтропияның өсу заңы)
Термодинамиканың бірінші бастамасы деп - термодинамикалық процестерге қатысты энергияның сақталу және түрлену заңын айтады.
Термодинамиканың екінші бастамасы - термодинамикалық процестердің жүру өту бағытын анықтайды, яғни табиғатта қандай процестердің болатынын немесе болмайтынын көрсетеді.
Термодинамиканың екінші бастамасының екі анықтамасы бар: олар энтропияның өсу заңының эквиваленті.
1) Кельвин бойынша: жалғыз нәтижесі қыздырғыштан алынған жылуды оған эквивалент жұмысқа айналдыратын айналмалы процесс мүмкін емес;
2) Клаузиус бойынша: бар нәтижесі - аз қыздырылған денеден көп қызған денеге жылу беру болып табылатын айналмалы процесс мүмкін емес;
45. Термодинамиканың үшінші бастамасы:
Термодинамиканың үшінші бастамасы - Нернст - Планк теоремасы - кельвин  нөл болғанда термодинамикалық жүйенің құбылысын көрсетеді
нөл болғанда термодинамикалық жүйенің құбылысын көрсетеді
(абсолютті нөл болғанда), температураның Кельвин нөліне ұмтылуына байланысты барлық денелердің энтропиясы тепе – теңдік жағдайда 0-ге ұмтылады. 
Жылу сыйымдылық Cv, Cp нөлге тең, егер T = 0 K-ге тең, себебі
dS = 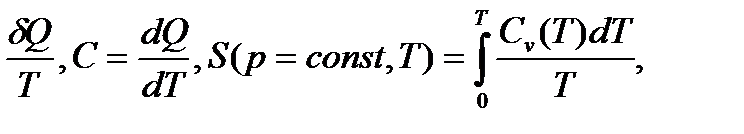
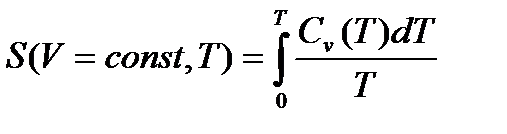
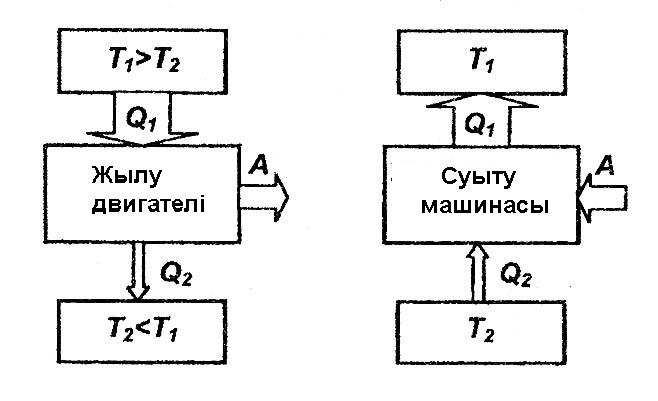
46. Жылулық двигательдер және тоңазытқыш машиналар.
Жылулық двигатель - бұл периодты жасалған двигатель, жылудың арқасында жұмыс жасайды.
Термостат деп денелермен жылу алмастыра алатын, өзінің температурасын өзгертпейтін термодинамикалық жүйені айтады.
Жұмыс жасайтын дене - бұл айналмалы процесс жасайтын және басқа денелермен энергия алмасатын дене.
Жылу двигателінің жұмыс жасау принципі: қыздырғыш деп аталатын жоғары температуралы Т1 термостаттан, цикл кезінде жылу Q1 көлемі алынады, ал аз температуралы Т2 термостатқа, ол тоңазытқыш деп аталады, цикл кезінде Q2 жылу көлемі беріледі, жасалатын жұмыс A = Q1- Q2
Двигательдің термиалық ПӘК-і.
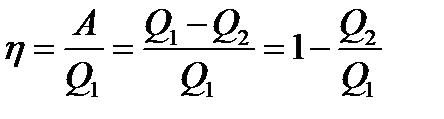 ПӘК 1- ге тең болу үшін Q2 = 0 тең болу керек, бірақ онда термодинамиканың екінші бастамасы орындалмайды.
ПӘК 1- ге тең болу үшін Q2 = 0 тең болу керек, бірақ онда термодинамиканың екінші бастамасы орындалмайды.
Жылулық двигательде жасалатын процеске қарсы процесс, тоңазытқыш машинада қолданылады: аз температуралы Т2 термостаттан цикл кезінде жылу көлемі Q2 алынады және термостатқа жоғарғы T1>T2 температурамен беріледі. Мұнда Q = Q1-Q2 =A немесе Q1 = Q2+A
Жүйеден Т1 термостатқа берілген жылу мөлшері Q1, Т2 термостаттан алынған жылу мөлшері Q2 – ден жүйеде жасалған жұмысқа үлкен.
Тоңазытқыш машинаның эффектілігі тоңазытқыш коэффицентімен 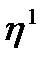 сипатталады, ол температурасы төмен термостаттан алынған жылу Q-нің тоңазытқыш машинаны жүргізуге жұмсалған жұмыс А-ға қатынасына тең:
сипатталады, ол температурасы төмен термостаттан алынған жылу Q-нің тоңазытқыш машинаны жүргізуге жұмсалған жұмыс А-ға қатынасына тең:

Дата публикования: 2015-10-09; Прочитано: 2843 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
