 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кондуктометрические измерения
|
|
Задачи работы: измерить сопротивление стандартных растворов хлорида калия и рассчитать константу ячейки.Ознакомиться кондуктометрическим определением степени и константы диссоциации слабых электролитов.
Оборудование и реактивы: мост переменного тока, кондуктометрическая ячейка; раствор KCl концентрацией 0,02 М;растворы уксусной кислоты концентрацией 0,05; 0,1 и 0,2 М; 3-4 колбы вместимостью 100 мл.
Опыт 1. Измерение электропроводности растворов. Определение константы кондуктометрической ячейки.
Выполнение работы: кондуктометрическую ячейку ополоснуть дистиллирован-ной водой и исследуемым раствором. Затем налить исследуемый раствор ячейку так, чтобы уровень жидкости был выше электродов. Далее замкнуть рубильник установки. При этом появится звук в телефоне (наушнике). Передвигая подвиж-ный контакт реохорда, балансировать мост (добиться минимального звука при сопротивлении магазина R2 = 100 Ом). Точные значения R3 и R4 найти путем определения правой и левой границы положения подвижного контакта на рео-хорде. Второе измерение провести при R2 = 200 Ом, а третье – при R2 = 300 Ом.
Результаты измерений записывать единым образом в следующей форме:
| 1-ое измерение | 2-ое измерение | 3-ее измерение |
| R2 = 100 Ом | R2 = 200 Ом | R2 = 300 Ом |
| R3 = | R3 = | R3 = |
| R4 = 100 − R3 = | R4 = 100 − R3 = | R4 = 100 − R3 = |
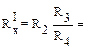
| 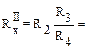
| 
|
Из трёх измерений вычислить среднее значение сопротивления R1:

Удельную электропроводность 0,02 М раствора KCl определить по таблице при температуре эксперимента (раствора):
| t0C | ϰ | t0C | ϰ | t0C | ϰ | t0C | ϰ |
| 0,002243 | 0,002393 | 0,002553 | 0,002712 | ||||
| 0,002294 | 0,002440 | 0,002606 | 0,002765 | ||||
| 0,002345 | 0,002551 | 0,002659 | 0,002919 |
Рассчитать значение константы сосуда. Экспериментальные данные представить в виде таблицы:
| Концентрация раствора KCl, моль/л | Удельная электропроводность раствора KCl | Сопротивление раствора R1, Ом | Константа ячейки K = ϰR1, м−1 |
| 0,02 М |
Опыт 2. Кондуктометрическое определение степени и константы диссоциации слабой кислоты.
Выполнение работы: измерить сопротивление растворов уксусной кислоты различных концентраций как указано в опыте 1, начиная с наиболее разбавлен-ного. Для каждой концентрации рассчитать удельную, эквивалентную электро-
проводности, соотношение Аррениуса (учитывая, что для СН3СООН l¥ = 350 см2/Ом), среднее значение константы диссоциации. Результаты экспериментов и расчетов занести в таблицу по форме:
| Концентрация кислоты, моль/л | Сопротивление раствора Rх, Ом | Удельная электропровод-ность раствора
ϰ = 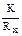 ,
Ом–1.см–1 ,
Ом–1.см–1
| Эквивалентная электропроводность раствора,  ϰ,см2/Ом.моль ϰ,см2/Ом.моль
| Степень диссоциации кислоты

| Константа диссоциации кислоты |
| 0,05 М | |||||
| 0,1 М | |||||
| 0,2 М |
В отчете представить мостовую схему измерения сопротивления, указать влияние концентрации на степень и константу диссоциации.
4.2.ПОТЕНЦИОМЕТРИЧЕСКОЕ ИЗМЕРЕНИЕ рН РАСТВОРОВ
рН растворов определяют колориметрическим, кондуктометрическим и потенциометрическим методами.
Потенциометрия основана на измерении электродвижущих сил (разности по-тенциалов) гальванических элементов. Гальванический элемент, используемый в потенциометрии, состоит из электрода определения и электрода сравнения. В качестве электрода определения (или измерения) используется электрод, отра-жающий свойства раствора (активность ионов, концентрации веществ). Разли-чают электроды I и II родов, а по механизму возникновения потенциала разли-чают ионно-металлические, окислительно-восстановительые (редокс-) и мем-бранные электроды.
Ионно-металлический электрод представляет собой металл, опущенный в раствор соли этого металла. Его потенциал зависит от концентрации (актив-ности) катиона в растворе и он функционирует как электрод I рода, т.е. на элек-троде протекает полуреакция: Mez+ + ze «Mo. Это электрод обратим относи-тельно катиона. На газовых электродах (хлорный, кислородный и др.), обра-тимых аниона, протекает реакция: Mo+ ze «Mez+. Газовый электрод представ-ляет собой пористый инертный металл (платина, палладий), насыщенный газом. Газ частично диссоциирует на ионы и электроны, в результате металлический проводник приобретает способность обмениваться ионами.
Электроды, способные обмениваться обратимо относительно и катиона, и аниона, являются электродами II рода. Они представляют собой малоактивный металл, покрытый слоем собственного труднорастворимого электролита, опущенный в раствор хорошо растворимого электролита с одноименными анионами. Примерами электродов II рода являются каломельный и хлорсеребряный электроды.
Мембранные электроды, в зависимости от природы мембраны, подразделяют на стеклянные электроды и электроды с твердой и, жидкой мембраной. У этих электродов потенциал зависит от активности нескольких или одного иона. Поэтому такие электроды называются ионселективными. Из них широко исполь зуется стеклянный электрод, рабочей частью которого служит мембрана из специального стекла толщиной 0,03 – 0,1 мм.
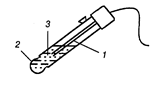 Рис.. Стеклянный электрод:
1 − внутренний электрод Ag, AgCl / HCl;
2 − стеклянная мембрана;
3 − внутренний раствор HCl.
Рис.. Стеклянный электрод:
1 − внутренний электрод Ag, AgCl / HCl;
2 − стеклянная мембрана;
3 − внутренний раствор HCl.
| Во внутренней части стеклянного электрода установлена серебряная проволока, покрытая нерастворимой солью AgCl и заполнена 0,1 М раствором хлороводородной кислоты (рН = 1). Принцип работы стеклянного электрода объясняют следующим образом: силикаты щелочных и щелочноземельных металлов, составляющих стекло, в кислой среде частично гидролизуются до кремниевой кислоты. При низких значениях рН (в кислой среде) ионы Н+ переходят в стекло, а при больших значениях |
(в щелочной среде) в раствор. В результате этих процессов на границе раздела стекло – раствор возникает скачок потенциала. ЭДС (разность потенциалов) зависит только от потенциала Е3. Его величина определяется разницей ионов водорода в растворах, омывающих стеклянную мембрану с внутренней и внешней стороны. В настоящее время созданы ионселективные электроды для определения различных ионов (катионов металлов, фторид-иона) и некоторых соединений (глюкозы, этанола и др.).
Для измерения разности потенциалов составляют гальваническую цепь, состоящую из электродов определения и сравнения. В качестве электрода сравнения используют электрод, потенциал которого не зависит от концентрации ионов водорода, в частности, каломельный или хлорсеребряный электрод. Например, гальваническая цепь для измерения рН с использованием стеклянного и хлорсеребряного электродов имеет вид:





 Ag AgCl Стеклянная Исследуемый AgCl Ag
Ag AgCl Стеклянная Исследуемый AgCl Ag
0,1M HCl мембрана раствор 1 M KCl
Е1 Е2 Е3 ЕХСЭ
 |  |
Внутренний электрод Внешний электрод
 сравнения сравнения
сравнения сравнения
Стеклянный электрод
Если представить, что стандартный потенциал стеклянного электрода Еост равен Е1 + Е2, а потенциал стеклянного электрода в растворе определяется как
Ест = Еост + 0,0001983ТlgH+, ЭДС гальванической цепи как ЕХСЭ − Ест., можно записать, что:  .
.
Различают прямые и косвенные потенциометрические методы.
Прямое потенциометрическое определение концентрации ионов, называют ионометрией. Таким путем определяют концентрацию физиологически активных ионов (H+, K+, Na+, Ca2+, NH4+, Cl−, Br−, I− и др.) в биологических жидкостях и тканях организма.
Косвенные методы используют для обнаружения точки эквивалентности в
титриметрии. В основе потенциометрического титрования лежит определение скачка потенциала электрода сравнения в ходе протекания реакции нейтрали-зации, окисления-восстановления, осаждения или комплексообразования с последующим расчетом концентрации ионов или вещества.
Стеклянный электрод имеет высокое сопротивление, и измерение ЭДС гальванических элементов, возможно только при помощи усилительной схемы
(электронного потенциометра). Измерительная шкала таких приборов градуирована в единицах рН и они называются рН-метрами.


 Рис.4. Общий вид рН-метра и панеля приборов
Рис.4. Общий вид рН-метра и панеля приборов
| рН-метр состоит из датчика и регистри-рующего прибора. Датчик представляет собой штатив, на котором смонтирована электродная система. В верхней части его укреплен полиэтиленовый сосуд с насыщен-ным раствором хлорида калия. В сосуд вставлен хлорсеребряный электрод сравне-ния. Раствор хлорида калия из сосуда через резиновую трубку поступает в стеклянный наконечник и оттуда в исследуемый раствор, обеспечивая электролитический контакт (замыкает электрическую цепь). Рядом с на-конечником укреплен стеклянный электрод и термометр для измерения температуры раствора. Ниже находится круглый поворот-ный столик для стаканчика с исследуемым раствором. В нерабочем состоянии электро-ды должны быть постоянно погружены в дистиллированную воду или 0,1 н раствор соляной кислоты. От датчика идут выводы электродок к регистрирующему прибору. Регистрирующий прибор представляет электронный потенциометр с предваритель-ным усилением тока (ЭДС) электродной системы. На передней панели прибора уста-новлен микроамперметр и выведены ручки управления. У рН-метра марки рН-340 шка-ла проградуирована в единицах рН сверху от 0 до 3, а снизу от –1 до 14. Переход от верх-ней шкалы к нижней осуществляется пере-ключателем «Размах». Для увеличения по-вышения точности измерений нижняя шкала разделена на несколько диапазонов: −1 – 2; 2 – 5; 5 – 8; 8 – 11 и 11 – 14. Переход на нуж-ный диапазон производится специальным |
переключателем. Например, если предел измерения стоит в положении 5 – 8, а в верхней шкале стрелка показывает значение 1,55, то прибор показывает значение рН, равный 5 + 1,55 = 6,55. На панели имеется также переключатель вида работ (измерение рН или ЭДС). Для настройки прибора по температуре исследуемого раствора имеется температурный компенсатор со шкалой от 0 до 100оС.
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 1311 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
