 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гидролиз солей. Оборудование и реактивы: пробирки, универсальный индикатор, растворы солей (NaCl, K2SO4, ZnCl2, Na2CO3
|
|
Задачи работы: изучить гидролиз солей, определить реакцию среды, влияние природы солей, основности кислот на степень гидролиза средних и кислых солей.
Оборудование и реактивы: пробирки, универсальный индикатор, растворы солей (NaCl, K2SO4, ZnCl2, Na2CO3, NaНCO3, Na2SO3, CH3COONa, Al2(SO4)3,).
Опыт 1. Обратимый гидролиз солей.
Выполнение работы: в пробирок налить по 5 - 6 капель растворов NaCl, K2SO4, ZnCl2, Na2CO3, CH3COONa, Al2(SO4)3. С помощью универсального индикатора определить реакцию среды. Объяснить результаты и написать уравнения соответствующих реакций в молекулярной и ионной формах.
Опыт 2. Влияние природы солей на степень их гидролиза
Выполнение работы: в 2 пробирки налить по 5 - 6 капель растворов Na2CO3 и Na2SO3. В пробирки прибавить по 1 капле универсального индикатора, определить реакцию среды. Составить уравнения гидролиза. Какая соль гидролизуется больше? Почему? Ответ подтвердить расчётами.
Опыт 3. Гидролиз солей многоосновных кислот
Выполнение работы: в 2 пробирки налить по 5 - 6 капель растворов Na2CO3 и NaНCO3. С помощью универсального индикатора определить рН растворов. Объяснить различие в значениях рН этих растворов расчётами. Написать уравнения гидролиза.
Вопросы и задачи для самоподготовки.
1. Что называют ионным произведением воды (константой автопротолиза)? В каком соотношении находится эта величина с константой диссоциации воды?
2. Как определяется числовое значение ионного произведения воды? Какова зависимость его от температуры?
3. Как взаимосвязаны между собой концентрации Н+ и ОН- ионов?
4. Как связана концентрация ионов Н+ (ОН-) в растворах сильных и слабых кислот и оснований с их молярной концентрацией?
5. Что называют водородным показателем (рН), гидроксильным показателем (рОН)? Чему равна их сумма?
6. Какие значения имеют концентрации ионов Н+ (ОН-) и рН (рОН) в различных средах?
7. При одинаковой молярной концентрации растворы каких электролитов будут иметь меньшее значение рН: а) HCl или CH3COOH; б)HNO2 или HClO; в) HCl или KOH?
8. Что называют гидролизом? Что понимают под гидролизом: а) ковалентным и ионным; б) по катиону, по аниону; в) простым и ступенчатым; г) обратимым и необратимым? Приведите примеры.
9. Как влияет на состояние равновесия Н2О «Н+ + ОН- и значение рН добавление гидролизующейся соли на примерах ZnCl2, K2CO3, Al2S3?
10. Для какой соли рН раствора будет иметь большее значение: а)NaNO3 или NaNO2; б) CH3 COOK или CH3COONH4; в) KClO или KClO3?
11. Можно ли при помощи кислотно-основного индикатора отличить друг от друга растворы солей:
а) NaClO4 и NaClO; б) KI и NH4I; в) KClO3 и KCl,
г) Na2CO3 и Zn(NO3)2; д) BeCl2 и BaCl2; е) MgSO4 и K2SO4?
12. Что называют гидролитическим равновесием?
13. Что называют степенью и константой гидролиза? Зависят ли они от природы соли, концентрации раствора, температуры?
14. Какой формулой выражают соотношение между константой и степенью гидролиза?
15. Как константа гидролиза связана с константой диссоциации слабого электролита?
16. Вычислите рН 0,05 %-ного раствора HNO3, зная, что плотность раствора 1г/мл, a(HNO3) = 100%. Ответ: 2,1.
17. Рассчитайте молярную концентрацию раствора СН3СООН, рН которого равен 3. Kа = 1,75 . 10-5. Ответ: 0,057 моль/л.
18. Вычислите рН раствора, полученного разбавлением водой 0,01 л 30 %-ного раствора NaOH (r = 1,328 г/мл) до 0,75 л. a = 70%. Ответ: 12,97.
19. Определите рН раствора, в 3 л которого содержится 8,1 . 10-4 моль ионов ОН-. Ответ: 10,43.
20. Рассчитайте рН раствора, в 0,4 л которого содержится 0,39 моль NH3, если Kb= 1,77 . 10-5. Ответ: 11,62.
21. Какое значение рН имеют растворы HCN, если: а) a = 0,0265%; б) a = 0,0084%? K(HCN) = 7,9 . 10-10. Ответ: 5,53; 5,03.
22. Вычислите рН 0,01 н раствора HCl, если a = 80%. Ответ: 2,1.
23. Вычислите рН 0,001 М раствора СН3СООН, если Kа = 1,8 . 10-5. Ответ: 3,87.
24. Вычислите рН 0,01 н раствора аммиака, если a = 0,042. Ответ: 10,62.
25. Степень диссоциации слабой одноосновной кислоты в 0,2 N растворе равна 0,03. Вычислите значения [Н+] и рОН этого раствора.
Ответ: [Н+] = 6,0 . 10–3 моль/л; рОН = 11,78.
26. Рассчитайте рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10 мл 0,5 М раствора NaOH и 15 мл воды (a = 1). Ответ: 0,82.
27. Каким значением рН характеризуется раствор СН3СООН (r = 1 г/мл), в кото-ром её массовая доля составляет 0,6 %? Сколько воды надо прибавить к этому раствору объёмом 1 л, чтобы значение рН стало равным 3. Kа = 1,75 . 10-5. Ответ: 3,49; 0,8 л.
28. В нормальном желудочном соке содержание соляной кислоты колеблется в пределах от 0,07 до 0,15%. Рассчитайте пределы изменения рН. Ответ: 1,72 – 1,39.
29. Венозная кровь имеет рН 7,33, а артериальная рН 7,36. Вычислите число ионов водорода в 100 мл крови.
Ответ: в венозной 2,77.1015, в артериальной – 2,59.1015.
30. Во сколько раз концентрация водородных ионов в крови (7,36) больше, чем в спинномозговой жидкости (рН 7,53)? Ответ: 1,413 раза.
31. Чему равны концентрация ионов водорода и pH раствора муравьиной кислоты (HCOOH), если a = 0,03, Ka = 1,8. 10-4? Ответ: 6. 10-3 моль/л, 2,22.
32. Рассчитайте константу гидролиза NH4Cl, зная, что Кb = 1,77 . 10-5.
Ответ: 5,65 . 10-10.
33. Вычислите Kгидр. фторида калия, зная, что Kа = 6,5 . 10-4. Ответ:1,538 . 10-11
34. Рассчитайте константы гидролиза следующих солей: HCOONa, HCOONH4, NH4NO3, зная, что Kа = 1,77 . 10-4, Kb = 1,77 . 10-5.
Ответ: 5,65 . 10-11; 3,19 . 10-6; 5,65 . 10-10.
35. Определите степень гидролиза и рН 0,005 N раствора KCN, если Ка = 4,9 . 10-10. Ответ: 0,063; 11,61.
36. Какая из двух солей гидролизуется в большей степени: а) KCN или KSCN (K(HCN) = 7,9 . 10-10, K(HSCN) = 1,4 . 10-1); б) Na2S или NaHS (K1а = 6 . 10-8 , K2а = 1 . 10-14)? Ответ подтвердите расчетом.
37. Как объяснить взаимоусиление гидролиза двух солей при смешивании их растворов? В каких случаях наблюдается это явление?
1.4. БУФЕРНЫЕ РАСТВОРЫ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: кислотность среды является важной характерис-тикой различных биологических жидкостей. Так, в плазме артериальной крови в здоровом организме значение рН колеблется в пределе от 7,36 до 7,44. Измене-ние рН крови на 0,2 – 0,3 единицы приводит к патологическим нарушениям. В организме имеется ряд регуляторов, поддерживающих концентрацию ионов водорода биологических жидкостей на постоянном уровне. К таким регуляторам относятся буферные системы.
Растворы слабых кислот или слабых оснований в присутствии их солей прояв-ляют буферное действие: рН таких растворов мало изменяется при разбавлении и при добавлении к ним небольших количеств сильной кислоты или щёлочи.
Для вычисления концентрации ионов Н+ и рН в буферных растворах слабых кислот HАn и их солей, образованных сильным основанием, применяют уравнения: 
где pKa = - lg Ka.
Аналогично можно рассчитать концентрацию ионов ОН- и рН в буферных растворах слабых оснований (KtOH) и их солей, образованных сильной кислотой: 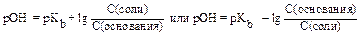 ,
,
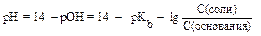 , где pKb = - lg Kb.
, где pKb = - lg Kb.
Если буферный раствор состоит из средней (Kt2An) и кислой солей (KtHAn) двухосновной кислоты H2An, то рН вычисляется по формуле:
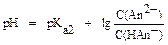 ,
,
где pKa2 = - lg Ka2, показатель константы диссоциации кислоты H2An по второй ступени.
Если буферная смесь образована кислыми солями (Kt2HАn и KtH2An) трехосновной кислоты H3An, то для расчета применяют уравнение:
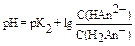
Важной характеристикой буферной системы является её ёмкость. Число эквивалентов кислоты или щёлочи, необходимое для смещения рН 1 л буферного раствора на одну единицу, называют буферной ёмкостью:  , приV(буф.p-pa) = 1 л, в общем виде:
, приV(буф.p-pa) = 1 л, в общем виде: 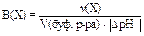
где Х - формула кислоты или щёлочи.
Чем больше в данную систему можно добавить кислоты или щелочи без из-менения рН, тем больше буферная ёмкость. Чем больше концентрации компо-нентов буферной смеси, тем меньше изменение рН от добавления кислоты или щелочи. Максимальное буферное действие оказывает раствор, компоненты кото-рого взяты в равных количествах и в больших концентрациях. При этом рН= рК.
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 2001 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
