 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Вычислите константу диссоциации уксусной кислоты, если a для 0,1 М раствора её равна 1,35%. Дано: С(СН3СООН) = 0,1 M a = 1,35% = 0,0135
|
|
Пример 1. Вычислите константу диссоциации уксусной кислоты, если a для 0,1 М раствора её равна 1,35%.
| Дано: С(СН3СООН) = 0,1 M a = 1,35% = 0,0135 Ka =? | Решение: CH3COOH «CH3COO- + H+ Ka = a2.С; Ka = (1,35.10-2)2.0,1 = 1,82.10-5 Ответ: Ka = 1,82.10-5. |
Пример 2. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26 . 1021 её молекул и ионов. Определите изотонический коэффициент и степень диссоциации СН3СООН.
| Дано: V(p-pa) = 1 л C(CH3COOH) = 0,01 M N(всех частиц) = 6,26.1021 i =? a =? | Решение: CH3COOH «CH3COO- + H+ 1) n(CH3COOH) = C.V(р-ра) = 0,01 моль 2) N (молекул) = 6,02.1023.0,01 = 6,02.1021 |
3) 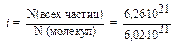 = 1,04
= 1,04
4)  = 0,04 или 4%.
= 0,04 или 4%.
Ответ: i = 1,04; a = 4%.
Пример 3. Вычислите ионную силу раствора, содержащего в 1 л 0,005 моль Cu(NO3)2 и 0,001 моль Al2(SO4)3, активность ионов Cu2+ в растворе (r = 1 г/мл).
| Дано: n(Cu(NO3)2) = 0,005 моль n(Al2(SO4)3) = 0,001 моль V(H2O) = 1 л r = 1 г/мл I (p-pa) =? а (Cu2+) =? | Решение:
Cu(NO3)2 = Cu2+ + 2NO3- (1)
Al2(SO4)3 = 2 Al3+ + 3 SO42- (2)
I = 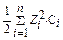
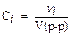
|
1) по уравнению (1): n(Cu2+) = 0,005 моль, n(NO3-) = 2 . 0,005 = 0,01моль.
2) по уравнению (2): n(Al3+) = 2 . 0,001моль, n(SO42-) = 3 . 0,001= 0,003 моль.
3) I (p-pa) =  [0,005 . 22 + 0,001 (-1)2 + 0,002 . 32 + 0,003 . (-2)2] = 0,03 (моль/л).
[0,005 . 22 + 0,001 (-1)2 + 0,002 . 32 + 0,003 . (-2)2] = 0,03 (моль/л).
4) а (Cu2+) = f . C(Cu2+); 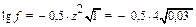 = 1,66; f = 0,46.
= 1,66; f = 0,46.
а (Cu2+) = 0,46 . 0,005 = 0,0023 (моль/л).
Ответ: I (p-pa) = 0,03 моль/л; а (Cu2+) = 0,0023 моль/л.
Пример 5. Определите концентрацию ионов ОН- и степень диссоциации аммиака в 0,01М растворе, зная что Kb = 1,77.10-5.
| Дано: C(NH3) = 0,01 моль/л Kb = 1,77.10-5 [OH-] =?, a =? | Решение:
NH3 + H2O «NH4+ + OH-
[OH-] = 
|
1) [OH-] =  = 4,2 . 10-4 (моль/л);
= 4,2 . 10-4 (моль/л);
2) a = 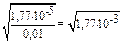 = 4,2 . 10-2 или a=
= 4,2 . 10-2 или a=  = 4,2 . 10-2.
= 4,2 . 10-2.
Ответ: [OH-] = 4,2 . 10-4 моль/л; a = 4,2 . 10-2.
Вопросы и задачи для самоподготовки.
1. Какие вещества называют электролитами? Чем отличаются водные растворы электролитов от растворов неэлектролитов?
2. Что понимают под электролитической диссоциацией (ионизацией)?
3. Какие величины являются количественными характеристиками процесса электролитической диссоциации (ионизации)?
4. На какие группы условно делят электролиты по степени их диссоциации? Приведите примеры.
5. Что называют активной концентрацией (активностью)? В каком соотношении она находится с аналитической концентрацией?
6. Что называют коэффициентом активности, и как изменяется его значение при разбавлении раствора?
7. Какими величинами определяется фактор активности для каждого иона и какой формулой выражается эта зависимость?
8. Что называют ионной силой раствора, и чем она определяется?
9. Запишите соотношения между ионной силой и молярной концентрацией
разбавленных растворов для: а) бинарных электролитов с однозарядными и
двухзарядными ионами типа KCl и ZnSO4;
б) трех- и четырехионных электролитов типа Na2SO4 и FeCl3.
10. Как и почему влияет на степень диссоциации слабого электролита введение в его раствор одноименного иона и разбавление раствора?
11. Почему константа диссоциации (ионизации) является более удобной харак-теристикой электролита по сравнению со степенью диссоциации?
12. Какой формулой выражается закон разбавления Оствальда? Каковы границы применимости закона?
13. От каких факторов зависит константа диссоциации (ионизации)?
14. Как найти концентрацию катиона слабого электролита KtAn, если известны: а) константа диссоциации и молярная концентрация электролита;
б) константа и степень диссоциации электролита?
15. Рассчитайте ионную силу раствора K2SO4, молярная концентрация которого равна 0,02 моль/л. Ответ: 0,06.
16. Определите ионную силу раствора, содержащего 1,62 г Са(НСО3)2 в 250 мл раствора. Ответ: 0,12.
17. Вычислите ионную силу раствора, содержащего 2,08 г BaCl2 и 5,85г NaCl в 500 мл раствора. Ответ: 0,08
18. Вычислите ионную силу и активность ионов в растворе, содержащем по 0,01 моль Ca(NO3)2 и CaCl2 в 1 л раствора.
Ответ: 0,06 моль/л; а (Ca2+) = 6,2.10-3, а (Cl-) = а (NO3-) = 1,5 . 10-2.
19. Степень диссоциации уксусной кислоты в 1N, 0,1N, 0,01N растворах соответственно равна 0,42%, 1,34% и 4,25%. Вычислите Ka для растворов указанных концентраций, докажите, что константа диссоциации не зависит от концентрации раствора.
20. Константа диссоциации HNO2 равна 5,1 . 10-4. Вычислите степень диссоциа-ции в её 0,01 М растворе и концентрацию ионов Н+.
Ответ: 22,6%; 2,26 . 10-3моль/л.
21. При какой молярной концентрации раствора степень диссоциации HNO2 равна 0,2? Kа = 4.10-4. Ответ: 0,01 моль/л.
22. Вычислите Ka уксусной кислоты, если степень диссоциации 0,01 молярного раствора при 250С равна 2%. Ответ: 4 . 10-6.
23. Константа диссоциации Н3РО4 по первой ступени равна 7,11 . 10-3. Прене-брегая диссоциацией по другим ступеням, вычислите концентрацию ионов Н+
в 0,5 М растворе. Ответ: 5,96 . 10-2 моль/л.
24. Какова концентрация ионов Н+ в 1N растворе HCN, если её Ka = 4,9 . 10-10? Какова масса (г) всех ионов, содержащихся в 1 л раствора этой кислоты?
Ответ: 2,21 . 10-5моль/л; 5,975 . 10-4 г.
25. Определите степень диссоциации и концентрацию ионов ОН- в 0,1N растворе NH3, если Kb = 1,77 . 10-5. Ответ: 1,33%; 1,33 . 10-3 моль/л.
26. Во сколько раз концентрация ионов Н+ в 1 N растворе HNO3 (a = 0,82) больше, чем в 1 N растворе H2SO4 по первой ступени диссоциации (a = 0,51)? Ответ: в 1,6 раза.
27. Сколько воды необходимо добавить к 300 мл 0,2 М раствора СН3СООН (Ka= 1,8 . 10-5), чтобы степень диссоциации кислоты удвоилась? Ответ: 900 мл.
28. В 1 мл 0,01 М раствора НСООН содержится 6,02 . 1018 её молекул и ионов. Определите степень диссоциации кислоты. Ответ: 13,3%.
1.3. АВТОПРОТОЛИЗ ВОДЫ. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ. ГИДРОЛИЗ СОЛЕЙ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: электростатическое взаимодействие полярных молекул воды приводит к их самоионизации (автопротолизу): Н2О + Н2О «Н3О+ + ОН- или в упрощенной форме: Н2О «Н+ + ОН-. При 25°С [Н+].[ОН-] = 1.10-14, в чистой воде [Н+] = [ОН-] = 1.10-7 моль/л.
В логарифмической форме: pH + pOH = 14, в чистой воде: pH = pOH = 7, где pH = - lg [H+], pOH = - lg [OH-], а [H+] - молярная концентрация ионов H+,
[OH- ] – молярная концентрация ионов ОН-.
В растворе одноосновной сильной кислоты HAn (a = 1):
HAn ® H+ + An-
[H+] = C(HАn); pH = - lg C(HАn)
В растворе однокислотного сильного основания KtOH (a = 1):
KtOH ® Kt+ + OH-
[OH-] = C(KtOH); pOH = - lg C(KtOH)
pH = 14 - pOH = 14 + lg C(KtOH).
В растворе одноосновной слабой кислоты: [H+] = C . a =  ;
;
pH= - lg C.a = - lg 
В растворе однокислотного слабого основания: [OH-]= С.a = 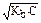 ;
;
pOH = - lg C.a= - lg 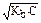 , pH = 14 - pOH = 14 + lg C.a = 14 + lg
, pH = 14 - pOH = 14 + lg C.a = 14 + lg 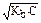
Если при растворении в воде соли образуется слабый электролит (слабая кислота, слабое основание или и то, и другое), то наблюдается ионный гидролиз, в результате которого равновесие Н2О «Н+ + ОН- смещается вправо. В растворе соли накапливаются ионы Н+ ([Н+] > [ОН-] – среда кислая) или ионы ОН– ([Н+] < [ОН-] - среда щелочная). В логарифмической форме: pH < 7 - кислая среда, pH > 7 - щелочная среда.
Гидролиз, являясь обратимым процессом (частным случаем химического равновесия), количественно характеризуется константой гидролиза (Kгидр.) и степенью гидролиза (h): Kгидр. =  . При 1 - h» 1, Kгидр. = h2. C.
. При 1 - h» 1, Kгидр. = h2. C.
В случае гидролиза соли, образованной катионом сильного основания и анионом слабой кислоты: Kгидр. = 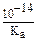 .
.
В случае гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты: Kгидр. =  .
.
В случае гидролиза соли, образованной катионом слабого основания и анионом слабой кислоты: K гидр. = 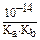 .
.
Дата публикования: 2015-09-18; Прочитано: 3928 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
