 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Молярная концентрация
|
|
Пример 5. Для определения времени рекальцификации кровяной плазмы применяется раствор CaCl2 с молярной концентрацией 0,025 моль/л. Сколько (г) CaCl2 необходимо для приготовления 250 мл этого раствора?
| Дано: C(CaCl2) = 0,025 моль/л V(p-p) = 250 мл m(CaCl2) =? | Решение: V(p-p) = 250 мл = 0,25 л m(CaCl2) = C(CaCl2).М(CaCl2).V(p-p) = 0,025.111.0,25 = 0,6938 (г). Ответ: 0,6938 г. |
Пример 6. Сколько (мл) раствора H2SO4 с плотностью 1,26 г/мл (34,6%) нужно для приготовления 3 л 0,12 М раствора?
| Дано: r(p-p1) = 1,26 г/мл w1%(H2SO4) = 34,6% V(p-p 2) = 3 л C2(H2SO4)=0,12 моль/л V(p-p 1) =? | Решение:
m1(H2SO4) = m2(H2SO4)
1) V(p-p1).r(p-p1).w1(H2SO4) = C2(H2SO4).M(H2SO4).V(p-p 2);
2) V(p-p 1).1,26.0,346 = 0,12.98.3 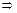 V(p-p1) =
V(p-p1) = 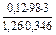 = 81 (мл)
Ответ: 81 мл. = 81 (мл)
Ответ: 81 мл.
|
Пример 7. Раствор NaCl с массовой долей 0,85% (r = 1,005 г/мл), называемый физиологическим раствором, применяется для внутривенных вливаний. Определите молярную концентрацию этого раствора.
| Дано: w1%(NaCl) = 0,85% r(p-p) = 1,005 г/мл C(NaCl) =? | Решение: I вариант: Пусть V(p-p) = 1000 мл = 1 л; тогда: m(р-р) = r(p-p).V(p-p) = 1,005.1000 = 1005 (г); w1(NaCl) = 0,0085; |
C(NaCl) =  =
=  =
= 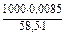 = 0,146 моль/л;
= 0,146 моль/л;
II вариант: В соответствии с формулой, приведённой в таблице 3:
C(NaCl) =  = 0,146 (моль/л).
= 0,146 (моль/л).
Ответ: 0,146 моль/л или 0,146 М.
Молярная концентрация эквивалента (нормальная концентрация)
Пример 8. Сколько (г) Na2CO3 требуется для приготовления 1,5 л раствора с молярной концентрацией эквивалента 0,15 моль/л. Раствор предназначен для реакции, протекающей до конца.
Дано:
V(p-p) = 1,5 л
 =0,15 моль/л
m(Na2CO3) =? =0,15 моль/л
m(Na2CO3) =?
| Решение:
Пример реакции:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
f экв.(Na2CO3) =  ; ;
 = =  .106 = 53 г/моль;
m(Na2CO3)= .106 = 53 г/моль;
m(Na2CO3)=  .V(p-p). .V(p-p).  = 0,15.1,5.53 = 11,925 г.
Ответ: 11,925 г. = 0,15.1,5.53 = 11,925 г.
Ответ: 11,925 г.
|
Пример 9. Сколько (мл) раствора СаСl2 с массовой долей 10% (r = 1,04 г/мл) необходимо для приготовления 2 л раствора с молярной концентрацией эквивалента 0,05 моль/л? Раствор предназначен для реакции, идущей до конца.
Дано:
w1%(СaCl2) = 10%= 0,1
r(p-p1) = 1,04 г/мл
V(p-p 2) = 2 л
 =0,05моль/л
V(p-p 1) =? =0,05моль/л
V(p-p 1) =?
| Решение:
Пример реакции:
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
f экв.(CaCl2) =  ; ;  = =  .111 = 55,5 (г/моль)
m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) = .111 = 55,5 (г/моль)
m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) =  . .  .V(p-p2), отсюда .V(p-p2), отсюда
|
V(p-p1) =  =
= 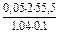 = 53,35 (мл).
= 53,35 (мл).
Ответ: 53,35 мл.
Пример 10. Определите нормальную концентрацию (молярную концентра-цию эквивалента) 50,1%-ного раствора H2SO4 с плотностью 1,4 г/мл. Раствор предназначен для реакции, идущей до конца.
Дано:
w1%(H2SO4)= 50,1%
 r(p-p1) = 1,4 г/мл r(p-p1) = 1,4 г/мл
 =? =?
| Решение: I вариант:
Пример реакции: H2SO4 + 2 KOH = K2SO4 + H2O
f экв.(H2SO4) =  ; ;  = =  .98 = 49 г/моль
Пусть V(p-p) = 1000 мл = 1 л; тогда: .98 = 49 г/моль
Пусть V(p-p) = 1000 мл = 1 л; тогда:
|
m(р-р) = r(p-p) . V(p-p) = 1,4 . 1000 = 1400 (г);
 =
=  =
=  = 14,2 моль/л (или 14,2 н).
= 14,2 моль/л (или 14,2 н).
II вариант: В соответствии с формулой, приведённой в таблице 3:
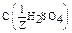 =
=  = 14,2 (моль/л).
= 14,2 (моль/л).
Ответ: 14,2 моль/л.
Пример 11. Определите нормальную концентрацию 0,5М раствора Al2(SO4)3, предназначенного для реакции образования гидроксида алюминия.
Дано:
C(Al2(SO4)3) = 0,5M
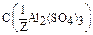 =? =?
| Решение:
Пример реакции: Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4
f экв.(Al2(SO4)3) =  ; ;
 = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л
Ответ: 3 моль/л (или 3 N). = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л
Ответ: 3 моль/л (или 3 N).
|
Пример 12. Определите титр 0,15 N раствора Na2CO3, предназначенного для реакции полного ионного обмена (см. задачу 8).
Дата публикования: 2015-09-18; Прочитано: 1326 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
