 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приготовление растворов заданной концентрации
|
|
Задачи работы: приготовить раствор определенной концентрации и из него определённый объём раствора меньшей концентрации.
Оборудование и реактивы: аналитические весы, мерные колбы на 1л, 250, 100, 50 мл, мерный цилиндр, пипетки, дистиллированная вода, сода.
Выполнение работы: рассчитать массу (навеску) соли (соды), которую нужно растворить в 1 л дистиллированной воды для получения раствора заданной концентрации. Навеску взвесить на аналитических весах с точностью до четвертого знака, внести в мерную колбу с притертой пробкой объемом 1 л и налить в 2/3 объема дистиллированной водой. Содержимое колбы перемешивать до полного растворения соли и залить дистиллированной водой до метки. Для приготовления из этого раствора более разбавленный раствор сначала рассчитать объем (мл) исходного раствора и объём воды, необходимых для получения раствора заданной (меньшей) концентрации. Для нахождения плотности растворов пользоваться таблицами. Проведённые расчёты представить преподавателю. После проверки преподавателем, приготовить заданный раствор смешением найденных объёмов исходного раствора и воды. Для приготовления раствора при помощи пипетки определённый объём жидкости перенести в мерную колбу. В мерной колбе этот раствор долить водой до метки и перемешать. Прибавление воды до метки производить сначала быстро, затем, когда до метки останется 1-2 см, по каплям. Отсчёт уровня жидкости в мерной колбе и мерном цилиндре производить по нижнему краю мениска. Перемешивание раствора в колбе осуществить путём её переворачивания и встряхивания. Приготовленный раствор сдать дежурному лаборанту.
Пример расчёта:
Требуется приготовить 50 мл 0,05 N раствора Na2CO3 из 0,2 М раствора Na2CO3, если f экв.(Na2CO3) =  .
.
Расчёт:  = 0,05 . 0,05 = 0,0025 (моль);
= 0,05 . 0,05 = 0,0025 (моль);  = 0,00125 (моль);
= 0,00125 (моль);

 = 0,00625 л или 6,25 мл 0,2 М раствора.
= 0,00625 л или 6,25 мл 0,2 М раствора.
Порядок оформления работы: в отчете записать все расчеты.
Вопросы и задачи для самоподготовки.
1. Каково содержание понятия «раствор»?
2. Какие существуют приближённые способы выражения концентрации растворов? Какие способы выражения концентрации растворов относятся к точным? Перечислите, дайте краткую характеристику каждому.
3. Что понимают под молярной концентрацией?
4. Что такое эквивалент, фактор эквивалентности, молярная масса эквивалента? Приведите примеры определения.
5. Что понимают под молярной концентрацией эквивалента (нормальной концентрацией)?
6. Что такое титр раствора?
7. Как математически связаны между собой способы выражения концентрации растворов?
8. Какое количество FeSO4 . 7H2O надо прибавить к 100 мл воды, чтобы получить 10%-ный раствор FeSO4? Ответ: 0,08 моль.
9. Сколько граммов CaCl2.6H2O необходимо растворить в воде для приго-товления 150 г раствора с массовой долей безводной соли 5%? Ответ: 14,8 г.
10. Глауберова соль (Na2SO4.10H2O) применяется при лечении заболеваний желудочно-кишечного тракта как слабительное. Сколько граммов этой соли необходимо для приготовления 250 г раствора с массовой долей безводной соли 5%? Ответ: 28,345 г.
11. К 250 г 10%-ного раствора кислоты добавили 500 г раствора той же кислоты с неизвестной массовой долей и получили 25%-ный раствор. Определите массовую долю кислоты в добавленном растворе. Ответ: 32,5%.
12. 125 л хлороводорода (н.у.) растворили в 500 мл воды. Определите массовую долю HCl в полученном растворе. Ответ: 29%.
13. До какого объёма надо разбавить 500 мл 20%-ного (по массе) раствора NaCl
(r = 1,152 г/мл), чтобы приготовить 4,5%-ный раствор (r = 1,029 г/мл)?
Ответ: до 2,488 л.
14. В каком объёме 1 М раствора серной кислоты содержится 4,9 г H2SO4? Ответ: 50 мл.
15. Какой объем (мл) 20%-ного раствора соляной кислоты с плотностью 1,098 г/мл потребуется для приготовления 1 л 2 М раствора? Ответ: 332,4 мл.
16. Чему равна молярная концентрация 96%-ного раствора H2SO4
(r = 1,84 г/мл)? Ответ: 18,77 М.
17. Какова процентная концентрация раствора, полученного смешиванием 100 мл 30%-ного раствора хлорида натрия (r = 1,20 г/мл) и 100 мл 5%-ного раствора хлорида натрия (r = 1,04 г/мл)? Ответ: 18,39%.
18. Вычислите массу 1 моль эквивалентов Н3РО4 в реакции образования дигидрофосфата натрия NaH2PO4. Ответ: 49 г/моль.
19. Определите фактор эквивалентности соли в реакции:
Al2(SO4)3 + 8 NaOH = 2 Na[Al(OH)4] + 3Na2SO4
20. Какую навеску (массу) Na2CO3 необходимо взять для приготовления 2 л 2 N раствора, используемого в реакции полного ионного обмена? Ответ: 212 г.
21. Какой объем 0,5 N раствора ВaСl2 можно приготовить из 24,4 г ВаСl2 . 2Н2О? Ответ: 400 мл.
22. Вычислите нормальную концентрацию и титр Н3РО4 в 13%-ном растворе, плотность которого 1,07 г/мл. Раствор предназначен для реакции, идущей до конца. Ответ: 4,258 N; 0,139174 г/мл.
23. Какой объём 3 N раствора должен быть прибавлен к 900 мл 0,5 N раствора этого же вещества, чтобы концентрация стала 1 N? Ответ: 225 мл.
24. На реакцию с раствором, содержащим 0,498 г Na2B4O7 . 10H2O, израсходовано 25,2 мл раствора HCl. Вычислите молярную концентрацию эквивалента (нормальную концентрацию) раствора соляной кислоты. Ответ: 0,103 N.
25. В какой массе эфира надо растворить 3,04 г анилина C6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг? Ответ: 109 г.
1.2. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3.
Теоретическое пояснение: В водных растворах сильные электролиты пол-ностью диссоциированы на ионы. Эффективную, условную молярную концен-трацию иона называют активностью (а) иона (i). Она связана с молярной концентрацией по уравнению аi = ¦.C i, где ¦ - коэффициент активности. Коэффициент активности для различных ионов изменяется при изменении концентрации раствора: в концентрированных растворах ¦ < 1, а в разбавленных приближается к единице. Коэффициент активности зависит от межионных взаимодействий, которые учитваются ионной силой раствора (I). Её вычисляют по уравнению  , где C i - молярная концентрация i -того иона; Z i - заряд i -того иона в единицах заряда электрона.
, где C i - молярная концентрация i -того иона; Z i - заряд i -того иона в единицах заряда электрона.
Между коэффициентом активности и ионной силой раствора существует зависимость (уравнение Дебая-Гюккеля): 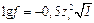
В отличие от сильных электролитов в водных растворах слабых электролитов не все молекулы электролита распадаются на ионы, а лишь небольшая их часть. Этот процесс количественно характеризуется степенью электролитической диссоциации (a), которая в зависимости от силы электролита принимает
значения 0 < a < 1; для сильных электролитов a > 0,3, для слабых a < 0,03, а для электролитов средней силы 0,03 < a < 0,3. Степень электролитической диссоциации равна  , где
, где
N i - число молекул электролита, распавшихся на ионы;
N - общее число молекул электролита в растворе (число молекул электролита, введенных в растворитель);
С i - молярная концентрация молекул электролита, распавшихся на ионы;
С - молярная концентрация электролита;
n i - количество вещества электролита, распавшегося на ионы;
n - количество вещества электролита, введённого в раствор.
Степень электролитической диссоциации зависит от ряда параметров, в том числе от концентрации, что делает её неудобной величиной для количественной характеристики процесса диссоциации. Независящей от концентрации слабого электролита в растворе является константа диссоциации. В растворе слабого электролита (кислоты HAn или основания KtOH) устанавливается химическое равновесие: HAn «H+ + An- (1)
KtOH «Kt+ + OH- (2)
количественно характеризуемое константой диссоциации: Kа - для слабой кислоты HAn, Kb - для слабого основания KtOH.
K и a связаны между собой. Согласно закона разбавления Оствальда  для слабой кислоты или слабого основания при 1- a» 1, Kд = a2.С. Следовательно, для одноосновной слабой кислоты: [H+] =
для слабой кислоты или слабого основания при 1- a» 1, Kд = a2.С. Следовательно, для одноосновной слабой кислоты: [H+] = 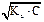 , [H+] = C . a, а для слабого однокислотного основания: [OH-] =
, [H+] = C . a, а для слабого однокислотного основания: [OH-] = 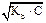 , [OH-] = C . a.
, [OH-] = C . a.
Дата публикования: 2015-09-18; Прочитано: 2719 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
