 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Массовая доля компонента
|
|
Пример 1. Глауберова соль Na2SO4 . 10H2O применяется при лечении желудочно-кишечных заболеваний как слабительное. Сколько (г) Na2SO4 . 10H2O нужно для приготовления 250 г раствора, с массовой долей Na2SO4, равной 5%.
| Дано: m(p-p) = 250 г. w(Na2SO4) = 5% = 0,05 m(Na2SO4.10H2O) =? M(Na2SO4) = 142 г/моль M(Na2SO4.10H2O)=322 г/моль | Решение:
1) m(Na2SO4 = 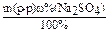 =
250.0,05 = 12,5 г;
2) по стехиометрической схеме:
n(Na2SO4) = n(Na2SO4.10H2O) =
250.0,05 = 12,5 г;
2) по стехиометрической схеме:
n(Na2SO4) = n(Na2SO4.10H2O)
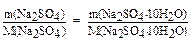 m(Na2SO4.10H2O) = 12,5.322/142 = 28,4 г.
Ответ: 28,4 г. m(Na2SO4.10H2O) = 12,5.322/142 = 28,4 г.
Ответ: 28,4 г.
|
Пример 2. Сульфат цинка ZnSO4 применяется в виде раствора с массовой долей, равной 0,25%, в качестве глазных капель. Сколько (г) воды нужно добавить к 25 г раствора с массовой долей ZnSO4, равной 2%, чтобы приготовить глазные капли?
      Дано:
m(p-p) = 25 г
w1(ZnSO4) = 2%
w2(ZnSO4) = 0,25%
m(H2O) =? Дано:
m(p-p) = 25 г
w1(ZnSO4) = 2%
w2(ZnSO4) = 0,25%
m(H2O) =?
| Решение: I вариант:
В соответствии с «правилом креста» составим схему:
2% 0,25
0,25%
0% 1,75
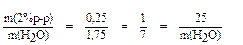 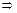

|
II вариант: Запишем выражение для расчета массовой доли соли в полученном растворе:
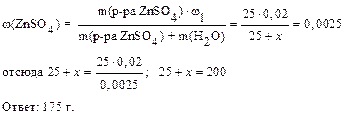
Пример 3. Для компенсации недостатка соляной кислоты в желудочном соке применяют её растворы как лекарственные формы. Сколько (мл) 24%-ного раствора HCl с плотностью 1,12 г/мл необходимо для приготовления 500 г раствора с массовой долей 5%.
| Дано: r(p-p1) = 1,12 г/мл w1%(HCl) = 24% m(p-p 2) = 500 г w2%(HCl) = 5% V(p-p 1) =? | Решение: m(HCl) =  = 500.0,05 = 25 г.
w1%(HCl) = = 500.0,05 = 25 г.
w1%(HCl) =  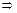 V(p-p 1) =
V(p-p 1) = 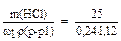 = 93 (мл).
Ответ: 93 мл. = 93 (мл).
Ответ: 93 мл.
|
Пример 4. Определите массовую долю (в %) HCl в растворе, полученном при смешивании 50 мл раствора с массовой долей 20% и 20 мл раствора, с массовой долей 10%.
Дата публикования: 2015-09-18; Прочитано: 1392 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
