 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Предмет и методы молекулярной физики
|
|
 Атомистические представления о веществе своими корнями уходят в древность (Демокрит, Эпикур – 25 веков тому назад). Первые истинные законы, которые легли в основу современной молекулярной теории, относятся к началу девятнадцатого столетия: законы Гей-Люссака (1802 г.), Дальтона (1809 г.), Авогадро (1811г.) и др. Работами Д. Максвелла и Л. Больцмана в середине хiх века была создана молекулярно-кинетическая теория практически в том виде, в котором мы сейчас ею пользуемся. Она носит название классической молекулярно-кинетической теории, поскольку в основе ее лежит применение законов классической механики (законов Ньютона) к движению атомов и молекул. Завершена классическая молекулярно-кинетическая теория работами Эйнштейна и Смолуховского в начале нашего столетия.
Атомистические представления о веществе своими корнями уходят в древность (Демокрит, Эпикур – 25 веков тому назад). Первые истинные законы, которые легли в основу современной молекулярной теории, относятся к началу девятнадцатого столетия: законы Гей-Люссака (1802 г.), Дальтона (1809 г.), Авогадро (1811г.) и др. Работами Д. Максвелла и Л. Больцмана в середине хiх века была создана молекулярно-кинетическая теория практически в том виде, в котором мы сейчас ею пользуемся. Она носит название классической молекулярно-кинетической теории, поскольку в основе ее лежит применение законов классической механики (законов Ньютона) к движению атомов и молекул. Завершена классическая молекулярно-кинетическая теория работами Эйнштейна и Смолуховского в начале нашего столетия.
Наряду с атомистическими представлениями, начиная с Аристотеля, существовало направление, отрицавшее атомную структуру, считавшее вещество непрерывным, единым. По Аристотелю, это единое вещество может иметь различные свойства в зависимости от добавки к нему невещественных элементов: холода, тепла, влажности и сухости. Позднее, в средние века, сюда добавили еще "божественную квинтэссенцию". Учение Аристотеля было одобрено церковью, и сомнения в его истинности объявлялось ересью.
В середине прошлого века в основу изучения свойств вещества без конкретных представлений о его строении был положен утвердившийся к тому времени опытный закон сохранения энергии. Развитый позднее работами немецкого физика и математика Гиббса, этот подход получил название термодинамического. Он развивался очень успешно и дал возможность объяснить многие и многие явления, но обостренная борьба между двумя, хотя и кардинально измененными, подходами к изучению материи продолжала существовать еще в начале нашего века. Теперь же оба раздела физики – молекулярная физика и термодинамика – развиваются параллельно, дополняют друг друга, и, слившись, образовали статистическую термодинамику.
Предметом изучения молекулярной физики является система, состоящая из большого числа атомов и молекул. Особенности их поведения обеспечивают особенности свойств вещества в трех его агрегатных состояниях: твердом, жидком и газообразном.
Газообразное состояние является простейшим из них. Молекулы газа слабо связаны друг с другом, движутся беспорядочно, поэтому газ может занимать сколь угодно большой объем. В физике существует понятие идеального газа, в котором взаимодействие между молекулами пренебрежимо мало, поэтому идеальный газ никогда не может конденсироваться. В отличие от него в реальном газе молекулы испытывают притяжение друг к другу, что в конечном итоге приводит к образованию жидкости.
Твердые тела сохраняют свою форму, поскольку взаимодействие между атомами достаточно велико, и каждый атом имеет свое положение равновесия. К твердым телам относят только кристаллические тела – металлы, сплавы. Есть еще так называемые полные кристаллы типа калийной соли. Их еще отличает твердость, хрупкость. Для каждого металла и полного кристалла характерен свой строгий геометрический порядок в расположении атомов, иначе говоря, свой тип кристаллической решетки. Существование решетки доказано рентгеноструктурным анализом. Последний позволяет определить и постоянную решетки – расстояние между центрами соседних атомов.
Поскольку эта величина оказалась равной двойному радиусу атома, считается доказанной плотная упаковка атомов в кристалле. Это означает, что атомы располагаются вплотную друг к другу, а в привычной нам картине кристаллической решетки точками показаны не атомы, а положения их центров (рис. 6.1). Хаотичное движение существует и здесь, но оно – колебательное. Положения равновесия находятся в узлах решетки.
Важной характеристикой атома является его радиус. В настоящее время найдены несколько методов расчета и опытного определения атомных радиусов. Для различных элементов они меняются в нешироких пределах: от 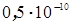 м для атома водорода до
м для атома водорода до 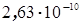 м для атома элемента ксенона. Радиусы атомов играют существенную роль при образовании кристаллических решеток, особенно, если эта решетка формируется из атомов разного сорта. В металлургии такие решетки носят название сплавов (заметим, что понятие сплава существенно шире, чем то, о котором сейчас идет речь).
м для атома элемента ксенона. Радиусы атомов играют существенную роль при образовании кристаллических решеток, особенно, если эта решетка формируется из атомов разного сорта. В металлургии такие решетки носят название сплавов (заметим, что понятие сплава существенно шире, чем то, о котором сейчас идет речь).
Из-за малости атомных размеров для их изменения часто используют внесистемную единицу – ангстрем (А), равную  м. Предметы, имеющие размеры порядка нескольких ангстрем, до сих пор остаются не наблюдаемыми непосредственно. Оптический микроскоп позволяет различать предметы порядка длины световой волны, то есть 2000...3000 А. Электронный микроскоп существенно снижает этот предел до 4,5...5 А, значит, атом все-таки остается ненаблюдаемым.
м. Предметы, имеющие размеры порядка нескольких ангстрем, до сих пор остаются не наблюдаемыми непосредственно. Оптический микроскоп позволяет различать предметы порядка длины световой волны, то есть 2000...3000 А. Электронный микроскоп существенно снижает этот предел до 4,5...5 А, значит, атом все-таки остается ненаблюдаемым.
|
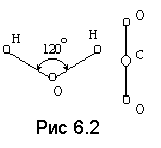
Соединение нескольких атомов образует молекулу. Строение молекул в настоящее время хорошо изучено, а наиболее крупные из них – органические – можно наблюдать в микроскоп. На рис.6.2 изображено строение молекул H2O и CO2. Как мы видим, представление о молекуле, как о материальной точке, далеко от истины, но им пользуются и поныне для решения определенного круга вопросов.
Помимо радиуса, важнейшей характеристикой атома является его масса. Ее часто называют атомной массой, соответствующая характеристика для молекулы – молекулярная масса. Она, как и любая масса, может быть измерена в граммах либо килограммах, но тогда она будет иметь очень малый порядок ( кг) из-за малости атома. Поэтому для атомов и молекул используют другую единицу измерения – атомную единицу массы (а.е.м.). Масса а.е.м. равна 1/12 массы атома углерода (изотоп С12 ), что в единицах СИ составляет»1,66×10-27 кг.
кг) из-за малости атома. Поэтому для атомов и молекул используют другую единицу измерения – атомную единицу массы (а.е.м.). Масса а.е.м. равна 1/12 массы атома углерода (изотоп С12 ), что в единицах СИ составляет»1,66×10-27 кг.
Массы атомов в а.е.м. указаны в периодической системе элементов Д.И. Менделеева. Они меняются в пределах от 1 а.е.м. для водорода до 238 а.е.м. для последнего природного элемента периодической системы Менделеева – урана. Массы атомов определены очень точно на опыте, существуют специальные таблицы, где они указаны с точностью до шести знаков. Эту точность дают приборы – масс-спектрографы, на которых в настоящее время определены массы атомов всех известных элементов. Работа масс-спектрографа основана на отклонении частиц в магнитном поле. Последнее зависит от массы частицы и может быть зафиксировано, скажем, на флюоресцирующем экране.
Масса атома (либо молекулы), выраженная в а.е.м., послужила основанием для введения моля – единицы количества вещества. Эта единица пропорциональна массе одной молекулы данного вещества и является для каждого вещества своей индивидуальной единицей. Она устанавливается следующим образом: назовем молем вещества такое его количество, которое содержит столько граммов, сколько а.е.м. содержит молекула этого вещества. Так, молекула водорода (Н2) имеет молекулярную массу 2 а.е.м., а молекула кислорода – 32 а.е.м. Соответственно моль водорода составит 2 г, а моль кислорода – 32 г.
Масса одного моля вещества называется его молярной массой и обозначается буквой m. Единицей измерения молярной массы будет, очевидно, г/моль. Для приведенных в качестве примеров водорода и кислорода
m 1 = 2 г/ моль; m 2 = 32 г/ моль.
Из-за ненаблюдаемости атомов и молекул – объектов изучения молекулярной физики – в ней пользуются методом гипотез. Он заключается в следующем: на основании наблюдений делается предположение (гипотеза), которое кладется в основу расчетов. Полученный результат сравнивается с экспериментом. Если ответ совпадает с расчетом, гипотеза становится теорий. Этот путь мы проследим на примере расчета средней скорости теплового движения, сделанного Максвеллом в середине прошлого столетия.
Помимо малости объекта у молекулярной физики есть еще одна особенность: она имеет дело с очень большим числом молекул (атомов). Нам трудно даже представить насколько велико их число. Приведем для сравнения две цифры: одно тысячелетие содержит около 2×1010 секунд, а один грамм меди содержит 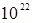 атомов. Поэтому молекулярная физика пользуется статистическими методами.
атомов. Поэтому молекулярная физика пользуется статистическими методами.
Статистика занимается наблюдением очень большого числа событий и делает вывод о значении средних величин, характеризующих эти события. Существует целый раздел математики, посвященный этим вопросам (математическая статистика). Приложение этого хорошо развитого аппарата к движению атомов и молекул привело к образованию из молекулярной теории статистической физики. Основная ее задача осталась прежней: нахождение макроскопических свойств системы по законам движения составляющих ее микрочастиц. В настоящее время статистическую физику разделяют на классическую и квантовую.
Молекулярная физика использует и теорию вероятностей, математический аппарат которой также хорошо развит. Изучение его связано с существенными временными затратами, но основные понятия теории вероятности легко усваиваются, так же, как и ее специфическая терминология.
Экспериментальной базой для построения классической молекулярной физики послужили опытные газовые законы, поэтому изучение раздела обычно начинают с них.
Дата публикования: 2014-10-19; Прочитано: 1988 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
