 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Опытные газовые законы. Число Авогадро
|
|
Состояние любого тела характеризуется четырьмя величинами, которые называют параметрами: давлением p, объемом V, температурой Т и массой m. Параметры связаны между собой и изменение одного приводит к соответственному изменению всех остальных. Переход из состояния, характеризуемого определенными значениями параметров, в состояние с другими их значениями носит название процесса.
Если процесс происходит с одним каким–либо постоянным параметром, его называют изопроцессом. Таких изопроцессов три: изотермический, изобарический и изохорный. Постоянны при этом соответственно T, p, и V. Соотношения, связывающие параметры одного состояния, называют газовым законом либо уравнением процесса. Уравнений изопроцессов соответственно три:
| при Т = const | pV = const; | (6.1) |
| при p = const | 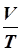 = const; = const;
| (6.2) |
| при V = const |  = сonst. = сonst.
| (6.3) |
Каждое из этих уравнений включает два параметра, показывает закон их изменения при не изменяющемся третьем параметре и постоянной массе.
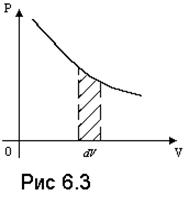
Заданные газовыми законами зависимости (6.1) – (6.3) нетрудно изобразить графически. Сделайте это самостоятельно, используя в качестве координат те переменные, которые есть в уравнениях. Графиков, как и уравнений, будет три. Но чаще всего используют координаты p-V, так как в этом случае на диаграмме видна работа, совершаемая при газовом процессе. Действительно, если направление силы совпадает с направлением перемещения, элементарная работа определяется выражением:
| dA = Fdl, | (6.4) |
где F – сила, dl – малое перемещение.Если вместо силы ввести давление, равное силе, деленной на площадь S, то получим:
| dA = pSdl = pdV, | (6.5) |
где dV – бесконечно малое изменение объема газа. Работа газа при конечном изменении его объема будет равна сумме элементарных работ, то есть
|
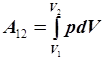 . .
| (6.6) |
Следовательно, работа газа равна площади под графиком зависимости давления от объема p ( V ), как это показано на рис. 6.3.
Следует особо остановится на четвертом газовом процессе – адиабатном. При нем меняются все три параметра, но весь процесс происходит без подвода к системе теплоты:
| dQ =0. | (6.7) |
Полезно всегда помнить, что газовые процессы, за исключением изохорического, связаны с изменением объема. Они могут протекать в двух направлениях, то есть являются либо сжатием, либо расширением и осуществляются за счет изменения давления или температуры. При адиабатном процессе меняются сразу и давление, и температура. Поэтому в последнем случае объем меняется более интенсивно, чем, скажем, при изотермическом процессе. Это отражается как на уравнении адиабаты, так и на графике (рис. 6.4). В уравнение адиабаты объем входит в степени g:
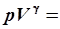 const, const,
| (6.8) |
где g – постоянная адиабаты, различная для различных газов и всегда большая единицы. Значит, одному и тому же изменению объема от 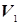 до
до 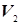 при изотермическом процессе будет соответствовать меньшее изменение давления, нежели при адиабатическом.
при изотермическом процессе будет соответствовать меньшее изменение давления, нежели при адиабатическом.
В курсе средней школы показано, что, объединяя три газовых закона вместе, можно получить объединенный газовый закон, а затем и уравнение Менделеева-Клапейрона, или иначе – уравнение состояния идеального газа:
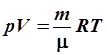 , ,
| (6.9) |
где R – универсальная газовая постоянная.
В этом уравнении связаны все параметры, характеризующие состояние вещества: p, V, T и m. Нетрудно показать, что из уравнения состояния можно легко получить любой газовый закон.
Входящая в уравнение (6.9) величина m есть масса одного моля. Поделив массу m всего вещества на массу одного моля, получим число молей
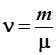 . .
| (6.10) |
Часто величину n именуют количеством вещества, забывая при этом сказать, что это количество выражено не в килограммах, а в молях.
Важнейшим следствием определения моля, имеющим место не только для газов, но и для всех трех агрегатных состояний вещества, является установление числа Авогадро – числа молекул в одном моле любого вещества. Выше мы установили, что величина моля для каждого вещества своя из-за того, что молекулы (атомы) у веществ разные: у одних молекул масса больше, у других – меньше, соответственно и моли будут разными. Короче: отношение масс молекул двух разных веществ будет равно отношению масс их молей. Далее: пусть масса одной молекулы будет m 0, тогда масса моля найдется произведением этой величины на число молекул в моле –  :
:
| m1 = m 01 N 1, | (6.11) |
и, соответственно, для второго вещества:
| m2 = m 02 N 2. | (6.12) |
Поделив полученные равенства одно на другое, получим:
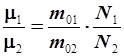
| (6.13) |
что, с учетом пропорциональности массы моля массе молекулы, установленной определением моля, приводит к выводу:
| N 1 = N 2 = N 0 , | (6.14) |
то есть число молекул в моле каждого вещества есть величина постоянная.
Иначе: моль любого вещества содержит одно и то же число молекул, называемое числом Авогадро. Это справедливо для всех агрегатных состояний. Киломоль более моля в 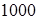 раз, значит, и число молекул в киломоле больше:
раз, значит, и число молекул в киломоле больше:
| N 0» 6×1023 моль–1 = 6×1026 кмоль–1. | (6.15) |
При создании международной системы единиц СИ было принято новое определение моля вещества, основанное на постоянстве числа молекул в нем. Связано это было с тем, что существовавшее ранее и данное нами выше определение не дает требуемой точности в определении моля. Действительно, там числа указаны с точностью только до двух знаков, хотя опытные значения масс атомов найдены, как уже говорилось, с точностью до шести знаков.
Если же определить моль вещества, как такое его количество, которое содержит N 0 молекул, вопрос о точности в определении моля отпадает. И при решении каждой конкретной задачи следует брать то число знаков, которое этой задаче соответствует. Естественно, чтобы взять моль вещества, никто не сможет отсчитать нужное число молекул. Поэтому практически используемым остается первое определение, которое первым исторически и возникло. Второе определение, связанное с числом Авогадро, лишь делает это определение более точным и лаконичным.
Число Авогадро было на опыте определено уже в нашем веке, в первой его половине (опыт Перрена, Франция), а в настоящее время существует более 20 методов его определения. Знание числа Авогадро дает возможность рассчитать массу молекулы или атома в килограммах для любого элемента периодической системы по массе его моля (или грамм-атома). Действительно,
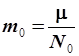 ; ; 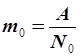
| (6.16) |
Подставив размерность в выражения (6.16), Вы легко можете убедиться, что найденное Вами значение массы будет выражено в граммах либо килограммах, но не в атомных единицах массы.
Известен закон Авогадро, имеющий место только для газов: при одинаковых давлениях и температурах в одинаковых объемах газов содержится одинаковое число молекул. Можно и по другому: моль любого вещества в газообразном состоянии при одинаковых температурах и давлениях занимает один и тот же объем. При нормальных условиях (760 мм рт. ст. и 0°С) этот объем равен 22,4 л. Этот закон был установлен опытным путем из расчетов химических реакций. Вы легко можете его проверить, пользуясь уравнением (6.9) Менделеева-Клапейрона.
Используя число Авогадро N 0, можно представить универсальную газовую постоянную R в виде произведения:
| R = kN 0, | (6.17) |
где k – новая постоянная, называемая постоянной Больцмана. Тогда
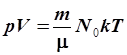 , ,
| (6.18) |
где величина
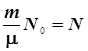
| (6.19) |
дает общее число молекул в массе m газа с молярной массой m. Следовательно,
| pV = NkT. | (6.20) |
Если ввести концентрацию молекул n = N/V, то получим уравнение
| p = nkT, | (6.21) |
то есть давление газа пропорционально количеству молекул в единице объема.
Дата публикования: 2014-10-19; Прочитано: 1108 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
