 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
|
|
Категория ХимияПо категории Химия имеется:Популярные статьи: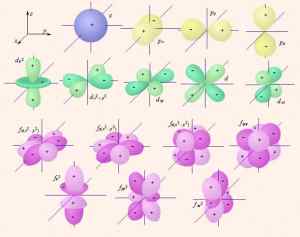
СТРОЕНИЕ АТОМААтом состоит из положительно заряженного ядра и электронов. Состояния электронов и других микрочастиц (протонов нейтронов и др.),их движения описываются квантовой механикой. далее » 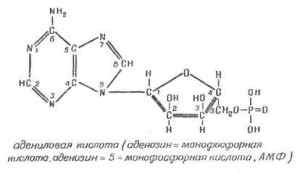
Нуклеиновые кислоты. Строение, свойства, биологическая рольНуклеиновые кислоты как один из компонентов живой материи были открыты в 1869 году швейцарским ученым Иоганом Мишером. В образовании нуклеиновых кислот могут участвовать две группы нуклеотидов – рибонуклеотиды и дезоксирибонуклеотиды. далее » 
Атомные и ионные радиусыАтомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах. далее » 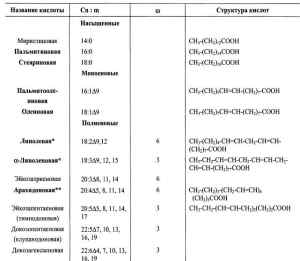
ХИМИЯ ЛИПИДОВЕще совсем недавно биохимия липидов считалась неинтересной и безнадежно запутанной областью. Однако с усовершенствованием и разработкой новых методов анализа и разделения липидов (в первую очередь – хроматографии) открылись возможности для их более глубоких исследований. подробнее » 
Алкены. АлкадиеныАлкены (олефины ) – это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью (непредельные углеводороды ряда этилена). Простейший представитель – этилен С2Н4 подробнее » 
Взаимодействие алюминия с серой при нагреванииВ концентрированных HNO3 и H2SO4 алюминий пассивируется, что позволяет хранить и транспортировать эти кислоты в емкостях из алюминия. Алюминий легко взаимодействует со щелочами, т.к. они растворяют оксидную пленку. подробнее » 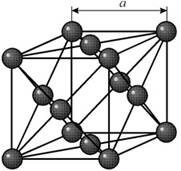
Кристаллическая структура вольфрамаОпределим число атомов меди в элементарной ячейке 1/8*8+1/2*6=4. 1/8 – доля каждого атома меди, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1/2 – доля каждого атома находящегося в грани элементарной ячейки меди. далее » 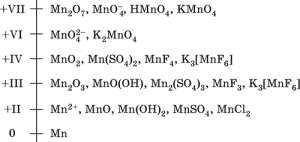
МарганецМарганец – элемент 4?го периода и VIIB?группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0. далее » 
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ВОДНО-ЭЛЕКТРОЛИТНОГО БАЛАНСА В ОРГАНИЗМЕБиомасса Земли на 3/4 состоит из воды. Содержание воды в организмах составляет примерно половину от количества воды во всех реках Земного шара. У разных организмов, и особенно в различных тканях, содержание воды колеблется в широких пределах далее » 
Сера самороднаяВ ряде случаев устанавливается химически чистая сера, но обычно загрязнена посторонними механическими примесями: глинистым или органическим веществом, капельками нефти, газами и пр. Известны редкие разновидности с изоморфной примесью подробнее » 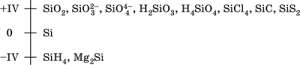
КремнийЭлектроотрицательность кремния невысока для неметаллов (2,25). Проявляет неметаллические (кислотные) свойства; образует оксиды, кремниевые кислоты, очень большое число солей – силикатов в виде цепей, лент и трехмерных сеток тетраэдров [SiO4], бинарные соединения. подробнее » 
Взаимодействие кислот с металламиПри взаимодействии соляной и разбавленной серной кислот с металлами окислителем является катион водорода Н+, поэтому они взаимодействуют с металлами, стоящими в ряду напряжений до водорода. подробнее » 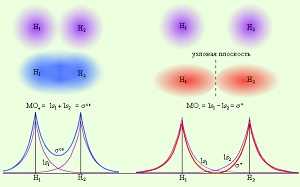
Условие образования молекулыМолекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участия в образовании химической связи не принимают. подробнее » 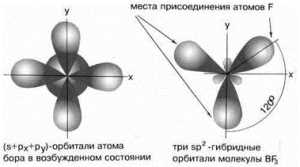
Sp- гибридизацияsp–Гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s - и p-неспаренные электроны. подробнее » 
Свойства элементов находятся в периодической зависимости от порядкового номераПериодически повторяющийся характер изменения состава электронной оболочки атомов элементов объясняет периодическое изменение свойств элементов при движении по периодам и группам Периодической системы. подробнее » 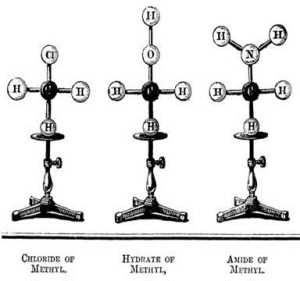
Химия во второй половине XIX вДля данного периода характерно стремительное развитие науки: были созданы периодическая система элементов, теория химического строения молекул, стереохимия, химическая термодинамика и химическая кинетика; блестящих успехов достигли прикладная неорганическая химия и органический синтез. подробнее » 
УглеводыУглеводы (сахара ) – важнейшие природные соединения, состоящие из углерода, водорода и кислорода. Углеводы подразделяются на моносахариды, дисахариды и полисахариды. подробнее » 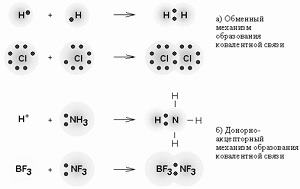
Типы химических связейПри образовании химической связи происходит перераспределение в пространстве электронных плотностей, первоначально принадлежавших разным атомам. подробнее » |