 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Решение. Находим массу раствора: 16 + 350 = 366 г Поскольку плотность равна 1 г/см3, то объем раствора равен 366 см3 = 0,366 дм3.
|
|
Пример 1. Вычислите осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г воды при 293 К. Плотность раствора считать равной 1.
Решение. Находим массу раствора: 16 + 350 = 366 г Поскольку плотность равна 1 г/см3, то объем раствора равен 366 см3 = 0,366 дм3.
Находимо осмотическое давление раствора:
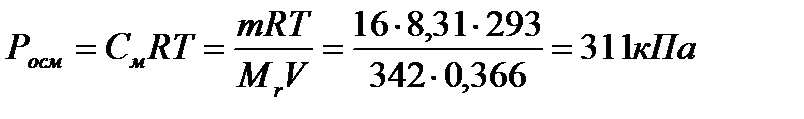
Пример 2. В 250 см3 раствора содержится 2,3 г растворенного вещества. Осмотическое давление при 27 0С равно 249 кПа. Вычислите молярную массу вещества.
Решение. V = 0,25 дм3; Т = 27+273 = 300 К
 . Откуда
. Откуда 
Пример 3. При 0 0С осмотическое давление 0,1 н раствора карбоната калия равно 272,6 кПа. Определите кажущуюся степень ионизации соли.
Решение. Находим молярную концентрацию 0,1 н раствора К2СО3 (fЭ = ½): 0,1 · ½ = 0,05 моль/л.
Находим изотонический коэффициент для раствора соли (сильный электролит):  . Откуда
. Откуда  .
.
К2СО3 ↔ 2К+ + СО32-, следовательно n = 3
Кажущуюся степень ионизации находим из соотношения: 
Пример 4. При 20 0С осмотическое давление раствора, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина, равно 243,4 кПа. Определите молекулярную формулу, если известен элементарный состав (в %) гематина: С – 64,6; Н – 5,2; N – 8,8; О – 12,6; Fe – 8,8.
Решение. Находим молярность раствора:  ; Т = 20 + 273 = 293 К;
; Т = 20 + 273 = 293 К;  .
.
Определяем молекулярную массу гематина: в 1 л раствора содержится 63,3 г гематина, это 0,1 моль. Таким образом, молярная масса гематина равна 63,3/0,1 = 633 г/моль.
Находим простейшую формулу гематина: С:Н:N:О:Fe =  = 34:33:4:5:1.
= 34:33:4:5:1.
Простейшая формула гематина: С34Н33N4O5Fe. Этой формуле соответствует молекулярная масса 633 г/моль, что совпадает с найденным выше значением. Таким образом, искомая молекулярная формула гематина С34Н33N4O5Fe.
Пример 5. Вычислите [H+], [HS-], [S2-] в 0,1 М растворе H2S.
Решение. Поскольку диссоциация сероводорода протекает преимущественно по первой ступени, то концентрацией [H+], образующихся при диссоциации по второй ступени, можно пренебречь и считать, что [H+] = [HS-] =  =
=  моль/л (К1 – константа диссоциации по первой ступени – табл. величина).
моль/л (К1 – константа диссоциации по первой ступени – табл. величина).
К2 – константа диссоциации по второй ступени – табл. величина).
 . Тогда [S2-] = 1·10-14 моль/л.
. Тогда [S2-] = 1·10-14 моль/л.
Пример 6. Вычислите концентрацию ионов водорода в 0,1 М растворе хлорноватистой кислоты (Ка = 5 · 10-8).
Решение. Находим степень диссоциации хлорноватистой кислоты:  . Отсюда [Н+] = α · См = 7 · 10-4 · 0,1 = 7 · 10-5 моль/л.
. Отсюда [Н+] = α · См = 7 · 10-4 · 0,1 = 7 · 10-5 моль/л.
Пример 7. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32 · 10-2. найдите константу диссоциации кислоты и значение рКа.
Решение. Подставляем данные задачи в уравнение закона разбавления Оствальда:  . Находим рКа = -lg Ka= - lg(1,77 · 10-5) = 5 – lg 1,77 = 5 – 0,25 = 4,75.
. Находим рКа = -lg Ka= - lg(1,77 · 10-5) = 5 – lg 1,77 = 5 – 0,25 = 4,75.
Пример 8. Вычислите ионную силу и активность ионов в растворе, содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2.
Решение. Определяем ионную силу раствора:

Находим коэффициенты активности ионов по формуле: 
 ; f = 0.3
; f = 0.3
 ; f = 0,74.
; f = 0,74.
Находим активность каждого иона по формуле, а = f · См:
a(Mg2+) = 0,02 · 0,3 = 0,006 моль/л;
a(SO42-) = 0,01 · 0,3 = 0,003 моль/л;
a(Cl-) = 0,02 · 0,74 = 0,0148 моль/л.
Дата публикования: 2014-11-18; Прочитано: 15005 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
