 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теория электролитической ионизации (диссоциации)
|
|
Электролитическая ионизация в растворе – это распад вещества на сольватиованные (гидратированные) ионы под действием молекул растворителя.
Данная теория была разработана шведским ученым Сванте Аррениусом в 1887 г. Основные ее положения:
1. Вещества распадаются на положительные и отрицательно заряженные ионы под действием растворителя.
2. Под дейсвием электрического тока положительно заряженные ионы двигаются к катоду (-) и называются катионами, а отрицательно заряженные двигаются к аноду (+) и называются анионами.
3. Диссоциация – процесс обратимый, наряду с распадом молекул протекает процесс соединения ионов в молекулу (молязация).

В своих работах Аррениус доказал, что распад молекул на ионы происходит уже в самом процессе растворения независимо от того, пропускают электрический ток через раствор или нет. Благодаря ионизации увеличивается число частиц в расторе, что ведет к повышению осмотического давления, однако он не учитывал взаимодействие растворенного вещества с растворителем (сольватационные процессы), данный процесс рассматривал как физический.
Основоположником современной теории электролитической ионизации как процесса, вызываемого сольватацией молекул, являются И.А. Каблуков и В.А. Кистяковский. Они расширили теорию Аррениуса с позиции химической теории растворов Д.И. Менделеева.
Основная причина электролитической ионизации – гидратация (сольватация) ионов, затрудняющая обратное соединение ионов (ассоциацию).
Дипольные молекулы воды взаимодействуют с ионами или полярными молекулами в растворе как за счет неподеленных электронных пар атома кислорода, так и за счет образования водородных связей:

Таким образом, катионы связаны с молекулами воды по типу донорно-акцепторного взаимодействия. Доморами являются атомы кислорода молекулы воды, имеющие свободные электронные пары, акцепторами - катионы, имеющие свободные орбитали.
Анионы связаны с водой водородной связью. Число координированных молекул воды называется координационным числом. Оно может бытьравно 4,6 и т.д. В общем виде растворение электролита в воде описывает уравнение:
КА + (x + у) Н2О ↔ [К(Н2О)х]+ + [А(Н2О)у]-
На практике пользуются упрощенным уравнением: КА ↔ К+ + А-
Таков механизм ионизации вещества ионного характера, кристаллическая решетка которых состоит из ионов.
При растворении в воде или других полярных растворителях соединений с ковалентной полярной связью происходит ионизация по типу:

Аналогично идет растворение галогенидов кобальта, алюминия, хрома, марганца,железа, меди и др.: СоCl2 + 6H2O = [Co(H2O)6]2+ + 2Cl-
Элементарных ионов кобальта в растворе нет. Часто аквакомплексы оказываются настолько прочными, что выделяются из растворов в составе кристаллогидратов, например: CuSO4·5H2O, AlCl3·6H2O, BeCl2·4H2O.
Количественной характеристикой электролитической ионизации является  - степень ионизации. Это отношение числа ионизированных молекул к общему числу:
- степень ионизации. Это отношение числа ионизированных молекул к общему числу:
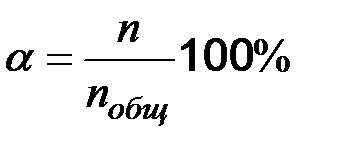 (65)
(65)
По степени ионизации условно электролиты делятся на сильные (α>30%), средние (30% >α > 3%) и слабые (α<3%).
Степень ионизации можно вычислить, если найти опытным путем изотонический коэффициент Вант-Гоффа:
 (66)
(66)
n- общее количество ионов на которые распадается электролит
Из сказанного выше следует, что растворы будут изотоничны, если при одинаковой температуре содержат одинаковое число частиц в еденице объема. У растворов с одинаковой молярной концентрацией осмотической давление выше в растворе электролита, с более высоким значением α. У растворов электролитов с одинаковыми СМ и α осмотическое давление выше у раствора электролита, диссоциирующего на болшее число частиц.
Факторы, влияющие на степень ионизации:
1. Природа растворителя
2. Природа растворенного вещества
3. Температура (ионизация – это эндотермический процесс, поэтому с повышением температуры ионизация увеличивается).
4. Концентрация (с увеличением концентрации уменьшается степень ионизации и наоборот).
5. Наличие одноименных ионов уменьшает степень ионизации.
К равновесиям в растворе слабого электролита применимы законы химического равновесия:


Киониз. - константа ионизации зависит от природы электролита и растворителя, от температуры и не зависти от концентрации. Это постоянная величина (прилож. 7) характеризует способность электролита распадаться на ионы. Чем больше Киониз., тем лучше вещество распадается на ионы. Для сильных электролитов Киониз >1
рКиониз = -lgКиониз (67)
Взаимосвязь константы ионизации и степенью ионизации выражает закон разбавления Оствальда:
 (68)
(68)
Для слабых электролитов, в очень разбавленных растворах:
 (69)
(69)
Степень ионизации слабого электролита возрастает с разведением раствора.
Ионизации подвергаются не только молекулы, но и сложные ионы. При ступенчатой ионизации кислот и оснований каждая ступень характеризуется собственной константой:
Н3РО4 ↔Н+ + Н2РО4- 
Н2РО4- ↔ Н+ + НРО42- 
НРО42- ↔ Н+ + РО43- 
Общая Киониз = К/ион. · К//ион· К///ион. Поскольку К/ион. > К//ион > К///ион, в наибольшей степени идет ионизация по первой ступени.
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток. К сильным электролитам, если растворителем является вода относятся: все соли, сильные кислоты (соляная, бромоводородная, йодоводородная, хлорная, серная, азотная), основания (гидроксиды лития, натрия, калия, рубидия, цезия, кальция, бария).
Данные вещества в растворах полностью диссоциируют на ионы. Однако экспериментально было доказано, что не все ионы, образовавшиеся в результате полной диссоциации электролита, являются свободными (электрическая проводимость растворов электролитов, которая связана с движением ионов, в концентрированных растворах оказалась незначительной). Это говорит о том, что в них ионы движутся медленнее, чем в разбавленных. Это обусловлено электростатическим взаимодействием между ионами и зависит от концентрации раствора, природы электролита и среды. Наличие этих сил приводит к тому, что каждый ион окружен «ионной атмосферой», состоящей из ионов с противоположным знаком (сложные агрегаты – ассоциаты). Движение положительных ионов в сторону отрицательного электрода тормозится силами притяжения отрицательно заряженной «ионной атмосферы» к положительному электроду (рис. 30). При разбавлении это взаимодействие ослабевает, подвижность ионов возрастает (максимальна при бесконечном разбавлении раствора).
 Активную (эффективную) концентрацию электролита (количество свободных ионов) называют активностью (Льюис, 1901 г).
Активную (эффективную) концентрацию электролита (количество свободных ионов) называют активностью (Льюис, 1901 г).
Активность – это условная
| Рис. 30. Торможение ионов в электрическом поле. |
 (70)
(70)
Для сильно разбавленных растворов она равна концентрации.
F – коэффициент активности, характеризует межионные взаимодействия. Чем они сильнее, тем меньше коэффициент, тем больше отличаются активность и концентрация. Это безмерная величина, характеризует степень отклонения свойств данного раствора от свойств идеального (если раствор разбавлять, то  и С=а)
и С=а)
Сила взаимодействия между ионами – F- зависят от: концентрации ионов и заряда.
Эти факторы учитываются величиной – ионной силой раствора (I) – полусумма произведений концентраций всех ионов в растворах на квадрат их заряда:
 (71)
(71)
Для сильно разбавленных растворов коэффициент активности (в приложении 7.) зависит только от ионной силы. Согласно теории сильных электролитов Дебая-Гюккеля (1923 г), коэффициент активности электролита связан с ионной силой раствора следующим соотношением:
 (72)
(72)
А – коэффициент, зависит от заряда иона, диэлектрической проницаемости среды и температуры.
Согласно теории электролитической диссоциации Аррениуса кислота – это соединение, распадающееся в водном растворе с образованием ионов Н+, а основание – вещество, при диссоциации которого образуются ионы ОН-. Эти определения являются весьма упрощенными, поскольку относятся только к водным растворам (кислотно-основные свойства проявляются в разных растворителях и даже при их отсутствии). Многие вещества не содержат в своем составе гидроксильных групп, и тем не менее являются основаниями. В данном процессе диссоциации не учитываются молекулы растворителя.
В развитии представлений о кислотах и основаниях появляется протеолитическая теория Бренстеда –Лоури (1923г). Согласно этой теории кислота – вещество, которое может отщеплять протоны, а основание – вещество, присоединяющее протоны.
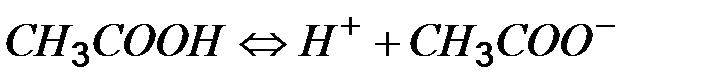

ацетет ион – основание хлорид ион – основание, более слабое. Следовательно, хлороводород – сильный электролит.
В каждом примере есть кислота и основание, которые называются сопряженными.
 В процессе нейтрализации два основания конкурируют за обладание протонами.
В процессе нейтрализации два основания конкурируют за обладание протонами.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар (НА, А- и ВН+, В).
Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:
НА + В ↔ А- + ВН+
pKa(HA) + pKb(А-)= 14
pKa(ВH+) + pKb(B) = 14
Согласно протеолитической теории сила кислот и оснований зависят от природы растворителя. Так, если в качестве растворителя хлороводорода вместо воды взять безводную уксусную кислоту (более слабое основание, чем вода), то равновесие не будет полностью смещено вправо, т.е. хлороводород - слабая кислота.

Наоборот, если уксусную кислоту растворить не в воде, а в жидком аммиаке (более сильное основание чем вода) диссоциация уксусной кислоты существенно увеличится.
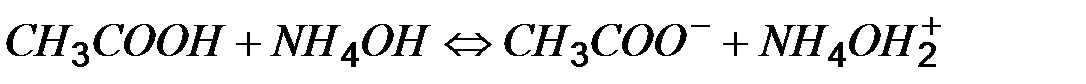
 Почти одновременно с протеолитической теорией Дж. Льюис предложит электронную теорию кислот и оснований. Согласно этой теории основания – соединения, имеющие неподеленные электронные пары и способные их обобществлять с другими молекулами или ионами. Кислоты – вещества, способные акцептировать электронные пары. (В теории Бренседа-Лоури нейтрализация – процесс передачи протона от кислоты к основанию, то здесь – происходит перенос электронной пары – донорно-акцепторное взаимодействие).
Почти одновременно с протеолитической теорией Дж. Льюис предложит электронную теорию кислот и оснований. Согласно этой теории основания – соединения, имеющие неподеленные электронные пары и способные их обобществлять с другими молекулами или ионами. Кислоты – вещества, способные акцептировать электронные пары. (В теории Бренседа-Лоури нейтрализация – процесс передачи протона от кислоты к основанию, то здесь – происходит перенос электронной пары – донорно-акцепторное взаимодействие).
По Льюису кислотами являются: Н+, Аl3+, BF3, основаниями – Н2О, NH3, Cl- (рис. 31).
Рис. 31. Кислоты и основания Льюиса.
Контрольные вопросы и задания
1. Учение о растворах. Раствор, растворитель, растворенное вещество, растворимость.
2. Гидратная теория растворов Д.И. Менделеева.
3. Сущность явления осмоса. Осмотическое давление. Закон Вант-Гоффа.
4. Изо-, гипо-, гипертонические растворы. Плазмолиз, тургор, гемолиз.
5. Роль осмотического давления в биологических системах.
6. Основные положения теории электролитической диссоциации С. Аррениуса и ее развитие И.А. Каблуковым.
7. Состояние ионов в водных растворах. Гидратация ионов, образование аквакатионов, сольватация.
8. Степень ионизации. Факторы, влияющие на степень ионизации.
9. Изотонический коэффициент. Константа ионизации.
10. Взаимосвязь степени и константы ионизации.Закон разбавления Оствальда.
11. Понятие об активности. Кислоты и основания по Бренстеду-Лоури и Льюису.
Дата публикования: 2014-11-18; Прочитано: 4231 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
