 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Во сколько раз изменится скорость реакции при увеличении давления в системе в 2 раза?
|
|
Пример 1. Во сколько раз изменится скорость реакции  при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
Решение. Предположим, что рассматриваемая реакция является элементарной, т. Е. для нее справедлив закон действующих масс

Принимая, что концентрация и парциальное давление связаны прямо пропорциональной зависимостью: 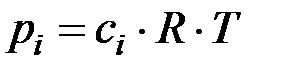 , получаем, что
, получаем, что  .
.
После увеличения давления в системе в 2 раза парциальное давление каждого из реагентов возрастает тоже в 2 раза, т.е.

Отсюда  , следовательно, скорость реакции увеличится в 8 раз.
, следовательно, скорость реакции увеличится в 8 раз.
Пример 2. Вычислите, во сколько раз возрастет скорость реакции при увеличении температуры на 40 0С, если температурный коэффициент реакции равен 3?
Решение. Согласно математическому выражению правила Вант-Гоффа

В нашем примере Т2 – Т1 = 400 С, подставив данные задачи в уравнение, получим uТ2/ uТ1 = 3 40/10 = 34 = 81, т.е. скорость реакции возросла в 81 раз.
Пример 3. При 353 К реакция заканчивается за 20 сек. Сколько времени длится реакция при 293 К, если температурный коэффициент реакции равен 2,5?
Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно – пропорциональная зависимость uТ2/ uТ1 = t1/ t2, где t1 и t2 – время протекания реакции при температурах Т1 и Т2, таким образом, в данном случае правило Вант-Гоффа можно записать следующим выражением:
t1/ t2 = gТ2 –Т1/10; t1 = t2 ∙ gТ2-Т1/ 10 = 20 ∙ 2,5 353-293/ 10 =20 ∙ 2,56 = 4879 сек =
= 1 час 21 мин 19 сек.
Пример 4. При синтезе аммиака равновесие установилось при следующих концентрациях реагирующих веществ: [N2] = 2,5 моль/л; [Н2] = 1,8 моль/л; [NH3] = 3,6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Исходя из уравнения реакции получения аммиака  определяем константу равновесия этой реакции:
определяем константу равновесия этой реакции:

Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль аммиака расходуется 1 моль азота, а на образование 3,6 моль потребовалось 3,6 /2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим первоначальную концентрацию  =2,5+1,8=4,3 моль/л. На образование 2 моль аммиака необходимо истратить 3 моль водорода, а для получения 3,6 молей аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л;
=2,5+1,8=4,3 моль/л. На образование 2 моль аммиака необходимо истратить 3 моль водорода, а для получения 3,6 молей аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л; 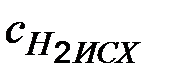 =1,8+5,4 =7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.
=1,8+5,4 =7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.
Пример 5. В каком направлении произойдет смещение равновесия систем:
а) 2SO3 = 2SO2 + O2 ∆H = +192 кДж
б) 2СО =СО2 + С ∆H = -171 кДж
в) COCl2 = CO + Cl2 ∆H = +113 кДж
при повышении давления, температуры и понижении концентрации О2 и СО?
Решение. а) реакция эндотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в прямую сторону (→). Количество моль газообразных исходных веществ – 2, продуктов – 3, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в обратную сторону (←). При понижении концентрации кислорода по принципу Ле-Шателье равновесие смещается в сторону прямой реакции (→).
б) реакция экзотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в сторону эндотермической реакции, т.е. в обратную сторону (←). Количество моль газообразных исходных веществ – 2, продуктов – 1, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в сторону прямой реакции (→). При понижении концентрации угарного газа по принципу Ле-Шателье равновесие смещается в сторону обратной реакции (←).
в) реакция эндотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в прямую сторону (→). Количество моль газообразных исходных веществ – 1, продуктов – 2, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в обратную сторону (←). При понижении концентрации угарного газа по принципу Ле-Шателье равновесие смещается в сторону прямой реакции (→).
Дата публикования: 2014-11-18; Прочитано: 4741 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
