 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Прямой р-ии >> обратной р-ии
|
|
Различают обратимые и необратимые реакции. Необратимыми реакциями называются такие, после протекания которых, систему и внешнюю среду одновременно нельзя вернуть в прежнее состояние. Они идут в одном направлении до полного расходования одного из реагирующих веществ.
 прямой р-ии >>
прямой р-ии >>  обратной р-ии
обратной р-ии
Многие химические реакции являются обратимыми, т.е. одновременно протекают в двух противоположных направлениях и не доходят до конца. Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние.
 прямой р-ии =
прямой р-ии =  обратной р-ии
обратной р-ии
Химическое равновесие характеризуется константой химического равновесия  .
.
Для реакции аА + вВ «сС + dD, из ЗДМ следует:
 (51)
(51)
где 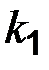 и
и  - константы скоростей прямой и обратной реакций,
- константы скоростей прямой и обратной реакций,  - равновесные концентрации веществ соответственно. В условиях равновесия концентрации всех реагентов связаны друг с другом, и изменение одной из них вызовет изменение других, только соотношение равновесных концентраций останется постоянным при данной температуре.
- равновесные концентрации веществ соответственно. В условиях равновесия концентрации всех реагентов связаны друг с другом, и изменение одной из них вызовет изменение других, только соотношение равновесных концентраций останется постоянным при данной температуре.
 - константа равновесия – определяется отношением произведений равновесных концентраций продуктов реакции на произведение равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов. В выражение константы равновесия входят только концентрации газообразных и растворенных веществ.
- константа равновесия – определяется отношением произведений равновесных концентраций продуктов реакции на произведение равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов. В выражение константы равновесия входят только концентрации газообразных и растворенных веществ.  для данной реакции при данной температуре величина постоянная.
для данной реакции при данной температуре величина постоянная.  - зависит от температуры, природы реагирующих веществ и не зависит от концентрации и присутствия катализатора. Катализатор, ускоряя и прямую, и обратную реакцию, способствует скорейшему установлению равновесия, но не оказывает влияния на состояние равновесия.
- зависит от температуры, природы реагирующих веществ и не зависит от концентрации и присутствия катализатора. Катализатор, ускоряя и прямую, и обратную реакцию, способствует скорейшему установлению равновесия, но не оказывает влияния на состояние равновесия.
Константа химического равновесия может быть рассчитана из изотермы Вант-Гоффа при  =0, являющейся термодинамическим условием химического равновесия:
=0, являющейся термодинамическим условием химического равновесия:
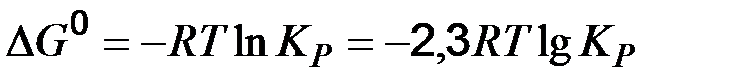 (52)
(52)
следовательно 
Константа равновесия имеет большое теоретическое значение и практическое значение. По ее величине можно судить о полноте протекания реакции. Если  > 1, то равновесие смещается в сторону прямой реакции, если
> 1, то равновесие смещается в сторону прямой реакции, если  < 1 – в сторону обратной. При
< 1 – в сторону обратной. При  =1 реакция находится в химическом равновесии. Тем не менее, состояние равновесия процесс динамический, поэтому значения константы равновесия позволяют судить о его сдвиге в ту или иную сторону.
=1 реакция находится в химическом равновесии. Тем не менее, состояние равновесия процесс динамический, поэтому значения константы равновесия позволяют судить о его сдвиге в ту или иную сторону.
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ (Принцип Ле Шателье)
Равновесие можно сместить внешним воздействием, руководствуясь принципомЛе Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону той реакции, которая способствует ослаблению этого воздействия.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов.
Например, при обычных условиях реакция N2 + O2 не идет (Δ H >0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO+1/2O2=CO2, Δ H <0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO+O2=2CO2, протекающая с уменьшением количества вещества, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличениеконцентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот.
Так, в реакции этерификации (образование сложного эфира) увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов реакции.

Контрольные вопросы и задания
1. Что такое средняя и мгновенная скорость реакции? Охарактеризуйте факторы, влияющие на скорость химических реакций (в гомогенных и гетерогенных системах).
2. Зависимость скорости от концентрации. Закон действующих масс. Константа скорости реакции.
3. Зависимость скорости реакции от температуры. Уравнение Аррениуса.
4. Характеристика энергии активации. Энергия активации каталитических реакций и сущность действия катализатора.
5. Понятие о ферментативном катализе в биологических системах. Гомогенный и гетерогенный катализ.
6. Обратимые и необратимые химические реакции. Константа равновесия и ее расчет по стандартным изменениям энергии Гиббса.
7. Химическое равновесие. Закон химического равновесия. Определение смещения равновесия при изменении условий на основании принципа Ле-Шателье.
8. Как изменится скорость прямой реакции: 2NO + O2 = 2NO2 при увеличении концентрации NO в три раза; при одновременном уменьшении концентрации NO и NO2 в два раза?
9. Как изменится скорость реакции при повышении температуры от 30 0С до 80 0С, если температурный коэффициент равен 3?
10. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 0С скорость реакции возрастает в 15,6 раза?
11. Запишите математическое выражение скоростей реакций, протекающих по уравнениям: 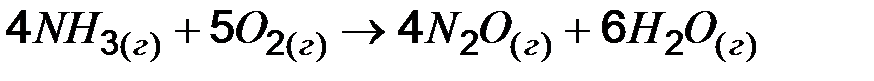

12. Как следует изменить давление в системе, чтобы скорость реакции увеличилась в 27 раз? Реакция протекает по уравнению: 
13. Реакция протекает в газовой фазе и заканчивается за 60 с. Как изменится время ее течения при повышении температуры на 400 С, если  =2, относительная скорость реакции
=2, относительная скорость реакции 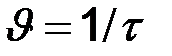 .
.
14. При некоторой температуре равновесные концентрации в системе  составляли соответственно [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) и кислорода.
составляли соответственно [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) и кислорода.
15. В какую сторону сместится равновесие в системе, если повысить t0, р, С одного из исходных веществ? Запишите выражение константы равновесия для приведенных ниже обратимых систем:
 +830 кДж
+830 кДж
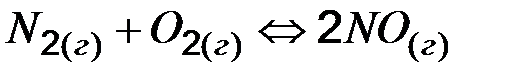 -181 кДж
-181 кДж
 +172 кДж
+172 кДж
Дата публикования: 2014-11-18; Прочитано: 1226 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
