 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства кислот
|
|
| Кислородсодержащие | Бескислородные |
| 1. Изменяют окраску индикатора | |
| лакмус-красный, метилоранж- розовый | |
| 2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода (кроме концентрированной серной кислоты, азотной кислоты любой концентрации) | |

| 
|
| 3. Взаимодействие с основными оксидами | |

| 
|
| 4. Взаимодействие с основаниями | |

| 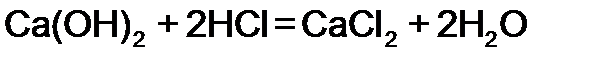
|
| 5. Взаимодействие с амфотерными оксидами | |

| 
|
| 6. Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
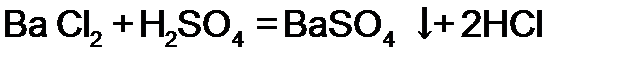
| 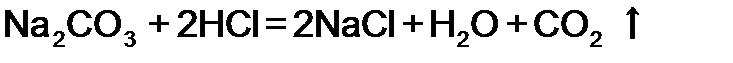
|
| 7. Разложение при нагревании | |
Слабые кислоты легко разлагаются

| 
|
Таблица 4
Получение оснований
| Щелочи | 1.Металл+вода | 

|
| 2.Оксид+вода | 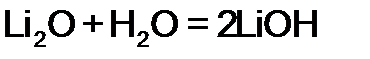
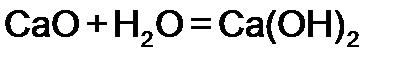
| |
| 3.Электролиз растворов щелочных металлов | 
| |
| Нерастворимые основания | Соль+щелочь | 
|
Таблица 5
Химические свойства оснований
| Щёлочи | Нерастворимые основания | |
| 1. Взаимодействие с кислотами | ||

| 
| |
| 2. Взаимодействие с кислотными оксидами | ||

| не характерны | |
| 3. Действие индикаторов | ||
| лакмус становится синим, фенолфталеин - малиновым, метиловый оранжевый - желтым | окраска не изменяется | |
| 4. Взаимодействие с амфотерными оксидами | ||
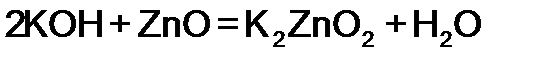
| не реагируют | |
| 5. Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | ||

| не реагируют | |
| 6.При нагревании | ||
| не разлагаются (кроме LiOH) | 
| |
| Амфотерные гидроксиды(Al(OH)3, Zn(OH)2, Be(OH)2 и другие | ||
Взаимодействуют с кислотами


| Взаимодействуют сo щелочами


| |
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
При полном замещении ионов водорода в молекуле кислоты на ионы металла образуются - средние (нормальные) соли. Общая формула Mex(ЭOy)n .. Получение и свойства см. табл. 6, 7.
При неполном замещении ионов водорода в молекуле кислоты на ионы металлаобразуются - кислые соли (гидросоли).
Это наблюдается при взаимодействии многоосновной кислоты с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли. Общая формула: Mex(HzЭOy)n.


При частичном замещении гидроксид-ионов в молекуле основания кислотным остаткомобразуются - основные соли (гидроксосоли).
Основные соли могут быть образованы только многокислотными основаниями в тех случаях, когда взятого количества кислоты недостаточно для получения средней соли. Общая формула: (MeOH)x(ЭOy)n.


Двойные соли состоят из ионов двух разных металлов и кислотного остатка. Например,  - калий натрий карбонат.
- калий натрий карбонат.
Смешанные соли – содержат один ион металла и анионы двух кислот  - алюминий хлорид сульфат.
- алюминий хлорид сульфат.
В состав комплексных солей входят сложные (комплексные) ионы (в формулах они заключаются в квадратные скобки. Пример:  ,
,

Таблица 6
Дата публикования: 2014-11-18; Прочитано: 708 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
