 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства оксидов
|
|
| Основные | Амфотерные | Кислотные |
Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания.
1. Взаимодействие с водой (оксиды щелочных и щелочноземельных металлов)
 2. С кислотами
2. С кислотами
 3. С кислотными оксидами
3. С кислотными оксидами
 4. С амфотерными оксидами
4. С амфотерными оксидами

| Проявляют свойства основных и кислотных оксидов
1. Взаимодействуют как с кислотами, так и с основаниями

 2. Реагируют с основными и кислотными оксидами
2. Реагируют с основными и кислотными оксидами 

| Реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты.
1. Большинство взаимодействуют с водой (искл.  ) ) 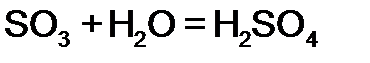 2. Со щелочами
2. Со щелочами
 3. С основными оксидами 3. С основными оксидами  4. С амфотерными оксидами
4. С амфотерными оксидами 
|
Гидроксиды – продукты прямого или косвенного взаимодействия оксидов с водой. Общая формула гидроксидов: ЭхОY · nH2O. По химическим свойствам различают кислотные (НХЭОу), основные и амфотерные (Ме(ОН)n) гидроксиды, соответствующие кислотным, основным и амфотерным оксидам.
Кислотные гидроксиды (к ислоты) - сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Получение и свойства (см. табл. 2,3).
Кислоты классифицируют по нескольким признакам:
1) по составу кислотного остатка – кислородсодержащие ( ) и бескислородные (
) и бескислородные ( );
);
2) по основности (количеству атомов водорода, способных замещаться атомами металла) – одноосновные ( ) двухосновные (
) двухосновные ( ), трехосновные (
), трехосновные ( ).
).
3) по силе электролита – сильные ( ), средней силы (
), средней силы ( ), слабые (
), слабые ( ).
).
Таблица 2
Дата публикования: 2014-11-18; Прочитано: 460 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
