 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Под активностью ионов подразумевают ту их эффективную (условную) концентрацию, соответственно которой они количественно проявляют себя в растворе
|
|
Активность иона а равна его молярной концентрации С, умноженной на коэффициент активности γ
а = С · γ
Коэффициенты активности различных ионов отличаются друг от друга. Кроме этого, они зависят от концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, что указывает на взаимодействие между ионами, приводящее к их взаимному связыванию. В разбавленных растворах γ приближается к единице. Это свидетельствует о слабом межионном взаимодействии, т.к. в таких растворах расстояния между ионами настолько велики, что действие меж-ионных сил почти не проявляется.
В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Установлено, что в таких системах величина γ зависит лишь от заряда иона и от ионной силы раствора I (табл. 11).
Таблица 11. Коэффициенты активности одно-, двух- и трехзарядных ионов в растворах с различной ионной силой
| Ионная сила раствора, I | Коэффициент активности | ||
| однозарядные ионы | двухзарядные ионы | трехзарядные ионы | |
| 0,001 | 0,96 | 0,87 | 0,72 |
| 0,002 | 0,95 | 0,81 | 0,63 |
| 0,005 | 0,92 | 0,72 | 0,48 |
| 0,01 | 0,89 | 0,63 | 0,35 |
| 0,05 | 0,81 | 0,43 | 0,15 |
| 0,1 | 0,76 | 0,34 | 0,084 |
| 0,2 | 0,70 | 0,24 | 0,041 |
| 0,5 | 0,62 | 0,15 | 0,014 |
Под ионной силой раствора понимают полусумму произведений молярных концентраций всех находящихся в растворе ионов на квадрат их заряда
I = ½ (C1z12 + C2z22 + … + Cnzn2),
где С1, С2, …, Сn – молярные концентрации ионов в растворе; z1, z2, …, zn – заряды ионов, находящихся в растворе.
В разбавленных растворах, ионная силы которых меньше или равна 0,01 (I ≤ 0,01), коэффициент активности рассчитывается по формуле lg γ = –0,5 z2  .
.
В растворах со средним разбавлением (0,5 > I > 0,01)
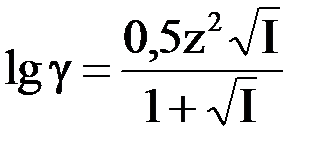
В еще более концентрированных растворах коэффициент активности рассчитывают по более сложным формулам.
Эрих Арманд Артур Йозеф Гюккель (1896 – 1980) – один из основоположников квантовой химии, создатель теории сильных электролитов (совместно с П. Дебаем).
 В 1922 Гюккель совместно с Максом Борном выполнил исследование вращательно-колебательных спектров многоатомных молекул. В 1923-1925 совместно с Петером Дебаем разработал теорию растворов сильных электролитов (теория Дебая-Гюккеля). Свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью были количественно истолкованы ими на основе предположения о полной диссоциации электролитов при учёте электростатического взаимодействия между заряженными частицами.
В 1922 Гюккель совместно с Максом Борном выполнил исследование вращательно-колебательных спектров многоатомных молекул. В 1923-1925 совместно с Петером Дебаем разработал теорию растворов сильных электролитов (теория Дебая-Гюккеля). Свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью были количественно истолкованы ими на основе предположения о полной диссоциации электролитов при учёте электростатического взаимодействия между заряженными частицами.
Ионная сила плазмы крови человека и большинства других биологических жидкостей близка к 0,15. Ионная сила изотонического раствора NaCl (0,9%) также равна 0,15. Таким образом, при проведении биохимических исследований, выполнении опытов на изолированных органах и тканях необходимо использовать не только изотонические растворы, но и растворы с одинаковой ионной силой.
При значительном увеличении ионной силы раствора в нем уменьшается количество свободной воды, не участвующей в гидратации ионов. Это приводит к дегидратации природных полиэлектролитов (белков, нуклеиновых кислот и др.), в результате чего изменяется их конформация и наблюдается частичное высаливание, т.е. выпадение данных полимеров из растворов в осадок.
Теория сильных электролитов, созданная Дебаем и Гюккелем, имеет достаточно сложный математический аппарат и безоговорочно применима к растворам, концентрация ионов в которых не превышает 0,1 моль/л. В этом случае выводы теории хорошо согласуются с экспериментальными данными.
Для растворов с более высокой концентрацией она уже не характеризует достаточно полно чрезвычайно сложную картину взаимодействия между всеми частицами, находящимися в системе.
В настоящее время установлено, что в более концентрированных растворах между заряженными ионами возможно образование ионных пар или ионных двойников, которые образуются за счет действия кулоновских сил и проявляют свойства электронейтральных частиц.
Например, образование ионных двойников из исходных индивидуальных ионов в растворе KCl можно схематически представить следующим образом:
K+ + Cl– = K+Cl–
Такая ассоциация ионов обнаружена в водных растворах калий-хлорида при концентрации соли ≈ 27-30 моль/л.
В неводных растворителях с низкой диэлектрической проницаемостью данные процессы возможны и при более низких концентрациях растворенных веществ.
Экспериментально установлено, что в концентрированных растворах электролитов наряду с незаряженными ионными парами могут образовываться и частицы более высокого порядка: ионные тройники, нейтральные ассоциаты, состоящие из двух и более ионных пар и т.д.
Вывод теоретических уравнений для расчета коэффициентов активности в таких системах возможен при установлении более точных представлений о строении электролитов, о природе и учете всех сил, которые действуют в растворе между находящимися в нем частицами растворителя и растворенного вещества.
Дата публикования: 2014-11-03; Прочитано: 1090 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
