 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Применение методов криоскопии и эбуллиоскопии
|
|
Определение понижения температуры замерзания или кипения раствора позволяет решать целый ряд вопросов, касающихся свойств данного раствора и растворенного вещества. Метод исследования, основанный на измерении температуры замерзания растворов, называется криоскопическим методом или криоскопией, а метод, основанный на измерении температуры кипения растворов получил название эбуллископического метода или эбуллиоскопии (рис. 28).
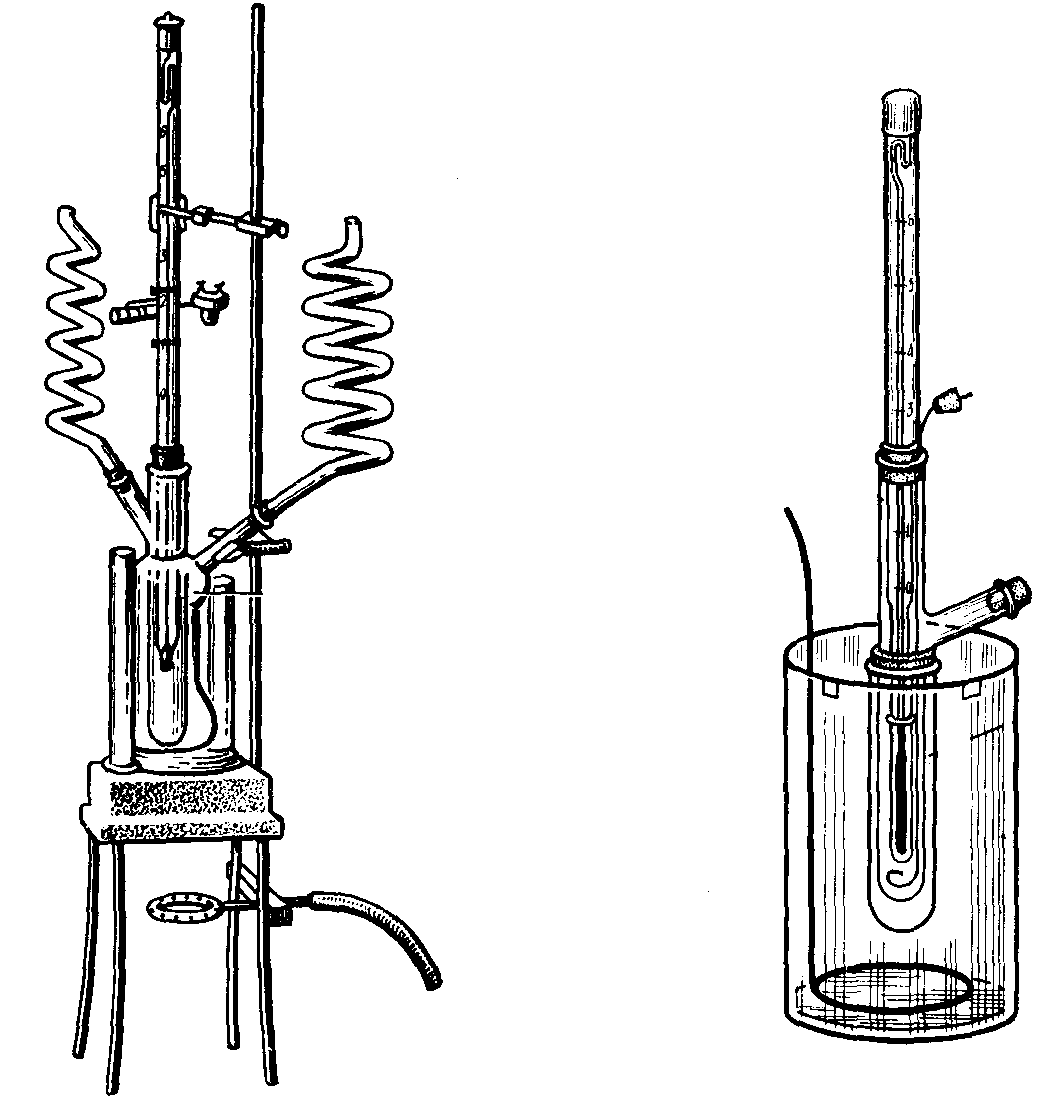
а б
Рис. 28. Аппараты для эбуллиоскопического (а) и криоскопического (б) определения молекулярных масс
В лабораторной практике криоскопический метод нашел значительно большее распространение по сравнению с методом эбуллиоскопии, т.к. измерять температуры замерзания растворов значительно проще и безопаснее, чем температуры их кипения.
Так, криоскопический метод часто используется для определения молекулярной массы вещества. Согласно следствию из закона Рауля
Dtзам. = K · m = 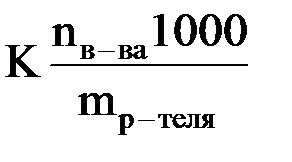
где nв-ва – химическое количество растворенного вещества;
mр-теля – масса растворителя (в граммах).
Учитывая, что 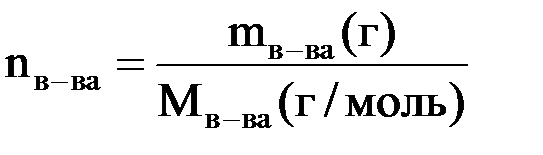 и подставив это выражение в вышестоящее уравнение, можно решить его относительно Мв-ва
и подставив это выражение в вышестоящее уравнение, можно решить его относительно Мв-ва
Мв-ва = K 
Измерение осмотического давления раствора с помощью осмометра часто бывает не совсем точным, т.к. на практике трудно подобрать подходящую мембрану, которая обладала бы идеальной полупроницаемостью. В этом случае более правильное значение росм. можно получить косвенным путем, например, с помощью метода криометрии.
Измерив Dtзам. раствора, можно рассчитать его моляльную концентрацию  .
.
Для разбавленных растворов (плотность которых близка к плотности воды) без большой погрешности можно принять, что их молярная концентрация С, выраженная в моль/дм3, равна моляльной концентрации m выраженной в моль/кг. Тогда в уравнение Вант-Гоффа для осмоса вместо С можно подставить m (моляльную концентрацию)
росм. = 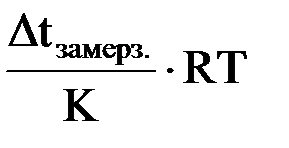
и рассчитать значение осмотического давления раствора.
С помощью метода криометрии можно определять суммарную моляльную концентрацию всех веществ, содержащихся в биологических жидкостях
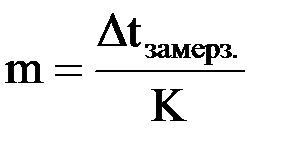 ,
,
а также степень диссоциации слабых электролитов и изотонический коэффициент Вант-Гоффа.
Дата публикования: 2014-11-03; Прочитано: 2262 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
